Elektronová afinita
Elektronová afinita (někdy též elektroafinita) je množství energie, které se uvolní, když neutrální atom nebo molekula získá elektron z vnějšku. Elektrony jsou snadněji vázány takovými atomy, jejichž elektronová valenční vrstva je zaplněna téměř jako valenční vrstva vzácného plynu (oktetové pravidlo).
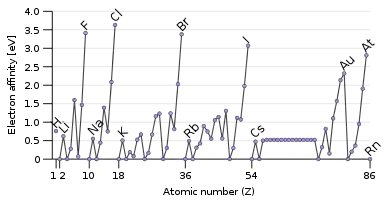
Po přijetí elektronu prvkem v základním stavu vzniká aniont. Anionty snadno tvoří prvky s velkou elektronovou afinitou (například halogenidy F, Cl, Br, I), kationty prvky s nízkou elektronegativitou (například alkalické kovy Li, Na, K, Rb).
S růstem atomového čísla elektronové afinity klesají v každé skupině periodické tabulky a rostou v každé periodě této tabulky.
Definice elektronové afinity
Elektronová afinita atomu nebo molekuly je definována jako množství energie uvolněné při připojení elektronu k neutrálnímu atomu nebo molekule (X) v plynném stavu (g) za vzniku záporného iontu:
X(g) + e− → X−(g) + energie
Obvyklý výraz pro výpočet Eea při připojení elektronu je:
Eea = Epočáteční – Ekonečná = −ΔE
Zachycení elektronu pro téměř všechny atomy znamená uvolňování energie. Pro každou reakci, která uvolňuje energii, má změna ΔE zápornou hodnotu. Tyto reakce se nazývají reakce exotermické. Jednotkou elektronové afinity je kilojoule na mol (kJ/mol) nebo elektronvolt (eV) na jeden atom.
Dělení prvků podle elektronové afinity
Podle elektronové afinity lze prvky rozdělit na:
- Elektropozitivní prvky – mají malou afinitu k elektronům, mají schopnost odštěpovat valenční elektrony a vytvářet kationty.
- Elektronegativní prvky – mají velkou afinitu k elektronům, mají schopnost poutat elektrony a vytvářet anionty.
Podle elektronové afinity lze prvky v periodické soustavě dělit také na:
Elektronová afinita a ionizační energie
Hlavní rozdíl mezi elektronovou afinitou a ionizační energií je ten, že elektronová afinita udává množství energie uvolněné při získání elektronu atomem, zatímco ionizační energie udává množství energie potřebné k odstranění elektronu z atomu. Ionizační energie vyjadřuje snahu atomu nebo iontu udržet si elektron, tedy „sílu“ jakou je elektron vázán v elektronovém obalu. Větší ionizační energie znamená obtížnější odtržení elektronu z atomu.
Elektronová afinita a elektronegativita
Elektronegativita je míra schopnosti atomu přijímat nebo ztrácet elektrony. Rovná se průměru elektronové afinity a ionizační energie. Například lithium má velmi nízkou ionizační energii i elektronovou afinitu, zatímco chlor má obě tyto hodnoty vysoké. Elektronegativita Cl bude tudíž vysoká a elektronegativita Li nízká. Nejvyšší elektronegativitu má fluor (4,0).
Elektronová afinita se měří pouze u atomů a molekul v plynném stavu, protože v pevném nebo kapalném stavu by se jejich energetické hladiny změnily kontaktem s jinými atomy nebo molekulami. Naměřené elektronové afinity prvků použil Robert Sanderson Mulliken k sestavení stupnice elektronegativit. Rozdíl elektronegativit dvou prvků poskytuje představu o charakteru chemické vazby mezi nimi. Ty podle velikosti elektronegativity dělíme na:
- Iontová vazba – vzniká, pokud je rozdíl elektronegativit větší než 2
- Kovalentní vazba – vzniká, pokud je rozdíl elektronegativit menší než 1
- Polární vazba – vzniká, pokud je rozdíl elektronegativit mezi hodnotami1 a 2, vazba je přechodem mezi vazbou kovalentní a iontovou.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Elektronová afinita na Wikimedia Commons
Obrázky, zvuky či videa k tématu Elektronová afinita na Wikimedia Commons - Text byl zčásti převzat z anglické a německé wikipedie