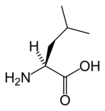
Leucin
Leucin (Leu, L) je proteinogenní aminokyselina patřící mezi esenciální aminokyseliny a musí proto být lidmi přijímán v potravě. Spolu s valinem a izoleucinem tvoří skupinu aminokyselin s rozvětveným řetězcem. Díky svému alifatickému postrannímu řetězci se řadí mezi hydrofobní aminokyseliny, a v proteinech je jeho hlavní rolí právě tvorba hydrofobních interakcí, jako je tomu v případě leucinového zipu, kterými se propojují některé proteiny interagující s DNA.
| Leucin | |
|---|---|
 | |
| Obecné | |
| Systematický název | (±)-2-Amino-4-methylpentanová kyselina |
| Triviální název | Leucin |
| Ostatní názvy | 2-amino-4-methylvalerová kyselina, α-aminoisokapronová kyselina |
| Anglický název | Leucine |
| Sumární vzorec | C6H13NO2 |
| Vzhled | bílé třpytivé hexagonální šupinky |
| Identifikace | |
| Registrační číslo CAS | 61-90-5 |
| SMILES | CC(C)CC(C(=O)O)N |
| InChI | InChI=InChI=1S/C6H13NO2/c1-4(2)3-5(7)6(8)9/h4-5H,3,7H2,1-2H3,(H,8,9) |
| Vlastnosti | |
| Molární hmotnost | 131,18 g/mol |
| Teplota tání | 282–287 °C |
| Teplota sublimace | 145–148 °C |
| Teplota rozkladu | 293–295 °C |
| Disociační konstanta pKa | 2,33 |
| Disociační konstanta pKb | 9,74 |
| Izoelektrický bod | 5,98 |
| Průměrný výskyt | 8,5 % |
| Bezpečnost | |
| NFPA 704 |  |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Historie
Leucin poprvé izoloval Joseph Louis Proust roku 1819 při studiu, čemu vděčí různé druhy sýrů své chuti, jelikož zjistil, že fermentací mléčného kaseinu a glutenu z pšeničné mouky lze získat kromě oxidu uhličitého, amoniaku a kyseliny octové i dvě další látky, které provizorně nazval jako kyselina (acide caséique, později určeno jako směs různých látek) a oxid (oxide caséeux, později určen jako leucin).[1][2] O rok později Henri Braconnot lépe přečistil nově získanou bílou krystalickou látku a zjistil, že se nejedná o oxid a že obsahuje dusík; pojmenoval ji leucin podle řeckého slova pro bílou (λευκό).[3]
Funkce a vlastnosti
Chemické vlastnosti
Postranní řetězec leucinu je tvořen rozvětvenou alifatickou isobutylovou skupinou: (CH3)2CH–CH2–, což zajišťuje jeho hydrofobní charakter. Protože isoleucin je isomer leucinu, mají velmi podobné vlastnosti a stejnou molekulovou hmotnost – při analýze proteinů hmotnostní spektrometrií je obtížné je navzájem odlišit, pokud se nezkoumá fragmentace jejich postranních řetězců, což pro náročnost provedení doposud není běžné.[4]
Funkce v proteinech
Leucin se pro svůj hydrofobní charakter vyskytuje především zabořený uvnitř proteinů, kde zprostředkovává hydrofobní interakce. Je málo reaktivní a většinou se proto neúčastní enzymatických reakcí přímo, ale může zajišťovat specifickou vazbu hydrofóbních ligandů, jako jsou například lipidy. Ve většině hydrofóbních interakcí může být snadno nahrazen jinými hydrofóbními aminokyselinami. Protože se větví až na svém γ-uhlíku, tedy poměrně daleko od peptidové kostry, má větší konformační volnost než jinak podobný isoleucin a valin, díky čemuž preferuje konformaci alfa-helix oproti beta-listu.[5] Leucin má významnou roli v řadě proteinových strukturních motivů.
Strukturní motivy proteinů
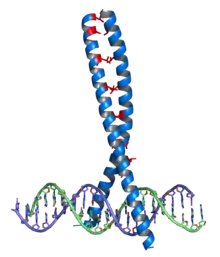
Leucin je významný v některých strukturních motivech, jako je leucinový zip nebo „repetice bohatá na leucin“ (leucine-rich repeat), kde zajišťuje hydrofobní interakce.
Leucinový zip se vyskytuje v řadě proteinů, které interagují s DNA (transkripční faktory), jedná se o dimerizační doménu, pomocí které spolu interagují dva proteiny: každý z nich nese alfa-helix bohatý na leucin (většinou každá sedmá aminokyselina[7]) Pravidelným opakováním leucinu vzniká na povrchu helixu hydrofobní pás, kterým se na sebe vážou. V dimerní formě jsou pak schopné interagovat se specifickými úseky DNA a např. tak ovlivňovat jejich transkripci (transkripční faktory).
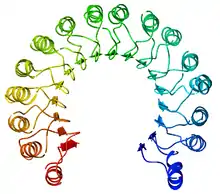
„Repetice bohatá na leucin“ (leucine-rich repeat) je další strukturní motiv bohatě využívající leucin, je složen z podjednotek (jeden list beta-listu–smyčka-alfa-helix), které se skládají do útvaru připomínajícího podkovu. Leucin je zde hluboce zabořen mezi beta-listy a alfa-helixy, které stabilizuje hydrofobními inferakcemi. Vnější strana tohoto strukturního motivu slouží pro interakce mezi proteiny, případně pro vazbu dalších molekul, vyskytuje se například v Toll-like receptorech.[8]
Přídatná látka a doplněk stravy
Leucin je klasifikován jako přídatná látka E641,[9] patří mezi látky zvýrazňující chuť a vůni. Komerčně je získáván z glutenu, kaseinu nebo keratinu. Používá se také jako přídatná látka v umělém sladidle aspartamu.[10]
Leucin je hojně využíván jako součást doplňků stravy v kulturistice, protože zvyšuje syntézu proteinů ve svalech a tím podporuje jejich růst. Svaly reagují na přísun energie a aminokyselin (stavebních bloků pro proteiny svalů), přičemž leucin má z aminokyselin největší efekt.[11] Leucin ovšem nemůže být používán samotný, protože jeho metabolismus je úzce propojen s valinem a isoleucinem (se kterými tvoří skupinu aminokyselin s rozvětveným řetězcem – BCAA) a dodání leucinu sníží množství těchto aminokyselin v plazmě, typicky se proto podává směs leucin:valin:isoleucin 2:1:1. I když dodávání BCAA (tedy leucinu) má v krátkodobém horizontu pozitivní účinky, doposud (k 2014) neexistují dlouhodobé studie určující bezpečné a efektivní dávky.[12] V kulturistice se jako doplněk stravy používá také beta-hydroxy-beta-methylbutyrát (HMB), což je produkt rozkladu leucinu a působí stejným mechanismem, jeho účinnost ale není dostatečně prostudovaná.[12]
Regulace tělesného metabolismu
Protože se jedná o esenciální aminokyselinu, hladina dostupného leucinu je pečlivě hlídána, a zároveň slouží jako známka dostupnosti ostatních aminokyselin. V trávicím systému přítomnost leucinu vyvolává v buňkách odpověď zahrnující změnu syntézy peptidických hormonů: snižuje produkci ghrelinu (signalizující hlad) a zvyšuje produkci inkretinu GLP-1 (signalizující nasycení) aktivací kinázy mTOR. Leucin zároveň dokáže procházet hematoencefalickou bariérou a stimulovat tak centra přímo v mozku, především hypothalamus a tak regulovat příjem potravy.[13] Leucin pomáhá při léčbě cukrovky 2. typu, protože jednak zvyšuje produkci inzulinu beta buňkami[14] a zároveň stimuluje přijímání glukózy svalovými buňkami, čímž tělu pomáhá zpracovávat krevní glukózu nezávisle na inzulínu a také zajišťuje ochranu před ztrátou svalové hmoty tím, že ve svalech aktivuje recyklaci glukózy stimulací alaninového cyklu.[15]
Zdroje
Leucin je pro lidi esenciální aminokyselina, proto musí být přijímán v potravě. Např. v sójových bobech, mase (hovězí, kuřecí prsa, losos), vejcích, arašídech, mandlích, čočce a cizrně.
Metabolismus
Odbourávání
Leucin je spolu s dalšími aminokyselinami s rozvětveným řetězcem odbouráván ve svalech, tukové tkáni, ledvinách a mozku, kde slouží jako zdroj energie, a ne v játrech, jak je běžné pro ostatní aminokyseliny. Za degradaci je zodpovědný dehydrogenázový komplex 2-ketokyselin s větveným řetězcem (BCKDC), rozklad postranní skupiny probíhá podobným postupem jako beta-oxidace mastných kyselin a výsledným produktem je acetylkoenzym A. Leucin je jednou ze dvou proteinogenních aminokyselin, které jsou výhradně ketogenní (druhá je lyzin), při odbourávání leucinu tedy nevzniká glukóza, ale ketolátka kyselina acetyloctová a jeho využívání jako zdroj energie vede ke ketóze.[16]
Při dědičné nemoci javorového sirupu (neboli leucinóze) nemá tělo funkční komplex (BCKDC) rozkládající aminokyseliny s rozvětveným řetězcem, tedy i leucin, takže při příjmu potravin bohatých na leucin a hladovění (kdy se odbourávají proteiny) se v těle hromadí toxické meziprodukty, jejichž projevem je zápach moči připomínající javorový sirup (případně karamel nebo sušené hrušky). Bez léčby je nemoc smrtelná, léčba spočívá v dietě limitující příjem leucinu.[17]
Odkazy
Reference
- PROUST, Joseph L. Recherches sur le Principe qui Assaisonne les Fromages. Ann Chim.. 1819, roč. 10, s. 29–49. (francouzsky)
- WISNIAK, Jaime. Joseph Louis Proust. R evista CENIC Ciencias Químicas [online]. 2012 [cit. 2014-12-30]. Roč. 43, čís. 1. Dostupné v archivu pořízeném dne 2014-12-31. (anglicky)
- VICKERY, Hubert. The History of the Discovery of the Amino Acids. Chemical reviews. 1931, roč. 9, čís. 2, s. 169–318.
- HURTADO, PP.; O'CONNOR, PB. Differentiation of isomeric amino acid residues in proteins and peptides using mass spectrometry.. Mass Spectrom Rev. 2012, roč. 31, čís. 6, s. 609–25. DOI 10.1002/mas.20357. PMID 22322410.
- BARNES, Michael R. Bioinformatics for Geneticists: A Bioinformatics Primer for the Analysis of Genetic Data. [s.l.]: Wiley, 2007. 576 s. ISBN 978-0470026205. Kapitola 14: Amino Acid Properties and Consequences of Substitutions, s. en. (anglicky)
- KOBE, B.; DEISENHOFER, J. Crystal structure of porcine ribonuclease inhibitor, a protein with leucine-rich repeats.. Nature. Roč. 366, čís. 6457, s. 751–6. DOI 10.1038/366751a0. PMID 8264799.
- Oxford dictionary of biochemistry and molecular biology; revised edition. Příprava vydání R. Cammack et al. New York: Oxford university press, 2006. ISBN 0-19-852917-1.
- BELLA, J.; HINDLE, KL.; MCEWAN, PA., et al. The leucine-rich repeat structure.. Cell Mol Life Sci. Aug 2008, roč. 65, čís. 15, s. 2307–33. Dostupné online. DOI 10.1007/s00018-008-8019-0. PMID 18408889.
- E641 - Leucin [online]. emulgatory.cz [cit. 2015-01-01]. Dostupné v archivu pořízeném dne 2015-01-01. (česky)
- WINTER, Ruth. A Consumer's Dictionary of Food Additives. 7.. vyd. [s.l.]: Three Rivers Press 608 s. Dostupné online. ISBN 0307408922. (anglicky)
- GARLICK, PJ.; GRANT, I. Amino acid infusion increases the sensitivity of muscle protein synthesis in vivo to insulin. Effect of branched-chain amino acids.. Biochem J. Sep 1988, roč. 254, čís. 2, s. 579–84. PMID 3052439.
- HELMS, ER.; ARAGON, AA.; FITSCHEN, PJ. Evidence-based recommendations for natural bodybuilding contest preparation: nutrition and supplementation.. J Int Soc Sports Nutr. 2014, roč. 11, s. 20. Dostupné online. DOI 10.1186/1550-2783-11-20. PMID 24864135.
- MCALLAN, L.; COTTER, PD.; ROCHE, HM., et al. Impact of leucine on energy balance.. J Physiol Biochem. Mar 2013, roč. 69, čís. 1, s. 155–63. DOI 10.1007/s13105-012-0170-2. PMID 22535285.
- KALOGEROPOULOU, D.; LAFAVE, L.; SCHWEIM, K., et al. Leucine, when ingested with glucose, synergistically stimulates insulin secretion and lowers blood glucose.. Metabolism. Dec 2008, roč. 57, čís. 12, s. 1747–52. DOI 10.1016/j.metabol.2008.09.001. PMID 19013300.
- LAYMAN, DK.; WALKER, DA. Potential importance of leucine in treatment of obesity and the metabolic syndrome.. J Nutr. Jan 2006, roč. 136, čís. 1 Suppl, s. 319S-23S. PMID 16365106.
- NELSON, David L.; COX, Michael M. Lehninger Principles of Biochemistry. [s.l.]: W.H. Freeman, 2013. Dostupné online. ISBN 978-1429234146. Kapitola 18: Amino Acid Oxidation and the Production of Urea. (anglicky)
- Leucinóza (MSUD) [online]. novorozeneckyscreening.cz [cit. 2014-12-31]. Dostupné online. (česky)
Externí odkazy
 Obrázky, zvuky či videa k tématu leucin na Wikimedia Commons
Obrázky, zvuky či videa k tématu leucin na Wikimedia Commons