NADH dehydrogenáza
NADH dehydrogenáza (NADH reduktáza, přesněji NADH ubichinon-reduktáza nebo prostě komplex I), EC 7.1.1.2 (před zavedením 7. třídy enzymů - translokas - v roce 2018 EC 1.6.5.3), je velký enzymatický komplex, který je prvním článkem v tzv. dýchacím řetězci buněčného dýchání. Hraje tedy zásadní roli ve vytváření tzv. protonového gradientu napříč vnitřní membránou mitochondrií, což následně umožňuje syntézu ATP. Jedná se zřejmě o největší membránový proteinový komplex ve vnitřní mitochondriální membráně vůbec, neboť dosahuje velikosti 650 kDa.[1]
Stavba
Skládá se z celé řady bílkovinných podjednotek, z nichž sedm je kódováno přímo v mitochondriální DNA a zbylých více než 30 podjednotek má svůj původ v jaderném genomu.[2] Celý komplex nicméně obsahuje i nebílkovinné složky, jako je molekula FMN (flavinmononukleotid) a 6–7 FeS center. NADH dehydrogenáza se tedy řadí do významné skupiny FeS metaloproteinů[1] a zároveň to je (s ohledem na obsah flavinového koenzymu) tzv. flavoprotein.[2]
Funkce
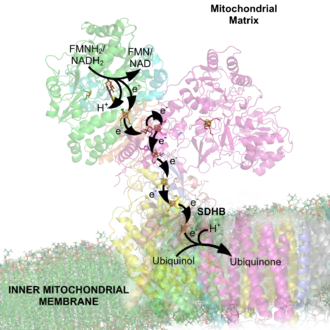
Souhrnně se dá reakce katalyzovaná tímto enzymem zapsat jako:[3] NADH + CoQ + 2H+ → NAD+ + H+ + CoQH2 (redukovaný)
S NADH reduktázou se nejprve asociuje redukovaný koenzym NADH a předává své elektrony celému multiproteinovému komplexu. Z jedné NADH přichází na komplex I dva elektrony a předávají je na FMN, z něj proudí elektrony na FeS klastry a z nich konečně na koenzym Q.[3] Výhodou přenašečů FMN a ubichinonu je, že mají tři oxidační stavy a mohou tedy přijmout oba elektrony od NADH. Následně mohou postupně odevzdávat elektrony na další přenašeč elektronů, tzn. na cytochromy v komplexu III.[1]
Průchodem elektronů komplexem NADH dochází k poklesu potenciálu asi o 360 mV, Gibbsova energie pro každé dva elektrony tedy činí 16,6 kcal/mol.[3] Většina této energie z průchodu dvou elektronů se použije na vlastní pumpování čtyř protonů do mezimembránového prostoru, a tak komplex I vlastně spoluvytváří protonový gradient.[4]
Onemocnění
Mutace v genu pro tento enzym může být příčinou onemocnění MELAS (mitochondrial encephalopathy, lactic acidosis, and stroke), což je jedno z typických mitochondriálních onemocnění.[4]
Reference
- VOET, Donald; VOET, Judith. Biochemie. 1.. vyd. Praha: Victoria Publishing, 1995. ISBN 80-85605-44-9.
- Oxford dictionary of biochemistry and molecular biology; revised edition. Příprava vydání R. Cammack et al. New York: Oxford university press, 2006. ISBN 0-19-852917-1.
- LODISH, Harvey, et al.. Molecular Cell Biology. New York: W.H. Freedman and Company, 2004. Dostupné online. ISBN 0-7167-4366-3.
- MURRAY, Robert K., Daryl K. Granner, Peter A. Mayes, Victor W. Rodwell. Harper's Illustrated Biochemistry. [s.l.]: Lange Medical Books/McGraw-Hill; Medical Publishing Division, 2003. ISBN 0-07-138901-6.
Externí odkazy
 Obrázky, zvuky či videa k tématu NADH dehydrogenáza na Wikimedia Commons
Obrázky, zvuky či videa k tématu NADH dehydrogenáza na Wikimedia Commons