Danishefského dien
Danishefského dien (také nazývaný Kitaharův dien, systematický název trans-1-methoxy-3-trimethylsilyloxybuta-1,3-dien) je organická sloučenina křemíku patřící mezi dieny; objevil ji Samuel J. Danishefsky, po kterém je také pojmenována.[3][4] Jelikož má dien vysokou elektronovou hustotu, tak je značně reaktivní při Dielsových–Alderových reakcích. Prudce reaguje s elektrofilními alkeny jako je maleinanhydrid. Díky methoxyskupině jsou adice velmi regioselektivní. Tato látka reaguje s aminy,[5] aldehydy, alkeny a alkyny.[4] Byly také popsány její reakce s iminy[6] a nitroalkeny.[7]
| Danishefského dien | |
|---|---|

Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | (1E)-1-methoxy-3-[(trimethylsilyl)oxy]buta-1,3-dien |
| Ostatní názvy | Kitaharův dien |
| Sumární vzorec | C8H16O2Si |
| Identifikace | |
| Registrační číslo CAS | 54125-02-9 |
| PubChem | 5366448 |
| SMILES | O(\C=C\C(O[Si](C)(C)C)=C)C |
| InChI | 1S/C8H16O2Si/c1-8(6-7-9-2)10-11(3,4)5/h6-7H,1H2,2-5H3/b7-6+ |
| Vlastnosti | |
| Molární hmotnost | 172,299 g/mol |
| Teplota varu | 68 až 69 °C (341 až 342 K)[1] |
| Hustota | 0,89 g/cm3 (20 °C)[1] |
| Bezpečnost | |
| [2] Varování[2] | |
| S-věty | S23 S24/25 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Poprvé byl tento dien připraven reakcí trimethylsilylchloridu s 4-methoxy-but-3-en-2-onem a chloridem zinečnatým:[8]
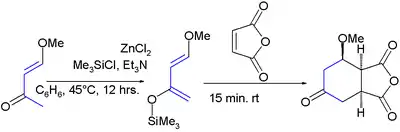
Látka je zajímavá díky dvěma svým vlastnostem: substituenty způsobují regiospecifickou adici na nesymetrické dienofily a u vzniklého produktu mohou navíc po adici proběhnout další reakce. Při reakcích s nesymetrickými alkeny dochází k vysoké regioselektivitě, přičemž je upřednostňována poloha 1,2 etherové skupiny vzhledem k alkenovému uhlíku (na kterém je nízká elektronová hustota). Vše je znázorněno na následujícím schématu aza Dielsovy–Alderovy reakce:[9]
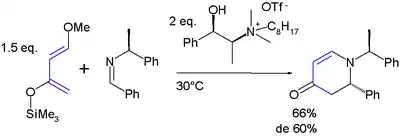 Danishefského dien při aza Dielsově–Alderově reakci
Danishefského dien při aza Dielsově–Alderově reakci
U produktu cykloadice je silylether synthonem tvorby karbonylové skupiny z enolu. Methoxyskupina snadno podléhá eliminační reakci za tvorby nové alkenové skupiny.
Byly popsány příklady využití Danishefského dienu v asymetrické syntéze.[10][11][12][13][14][15][16][17][18][19][20][21] Byly též popsány deriváty tohoto dienu.[22]
Reference
V tomto článku byl použit překlad textu z článku Danishefsky's diene na anglické Wikipedii.
- Sicherheitsdatenblatt Merck[nedostupný zdroj].
- 1-Methoxy-3-trimethylsiloxy-1,3-butadiene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Samuel J. Danishefsky; Kitahara, T. Useful diene for the Diels-Alder reaction. J. Am. Chem. Soc. 1974, 96, 7807-7808. DOI:10.1021/ja00832a031
- Strategic Applications of Named Reactions in Organic Synthesis, Laszlo Kurti,Barbara Czako, Elsevier 2005
- Acid-Free Aza Diels−Alder Reaction of Danishefsky's Diene with Imines Yu Yuan, Xin Li, and Kuiling Ding: Organic Letters 2002 4 (19), 3309-3311 DOI:10.1021/ol0265822
- Alkaline salt-catalyzed aza Diels–Alder reactions of Danishefsky’s diene with imines in water under neutral conditions Catherine Loncaric, Kei Manabea and Shū Kobayashi Chem. Commun., 2003, 574-575 DOI:10.1039/B300880K
- Exo selective Diels–Alder reaction of nitroolefins with Danishefsky's diene Manabu Node, Kiyoharu Nishide, Hitoshi Imazato, Ryuichi Kurosaki, Takehisa Inoue and Takao Ikariya Chem. Commun., 1996, 2559-2560 DOI:10.1039/CC9960002559
- Preparation and Diels-Alder Reaction of a Highly Nuclerophilic Diene. Org. Synth., Coll. Vol. 7, p.312 (1990); Vol. 61, p.147 (1983). Link Archivováno 17. 2. 2012 na Wayback Machine
- Asymmetric aza-Diels-Alder reaction of Danishefsky's diene with imines in a chiral reaction medium Pegot B, Nguyen Van Buu O, Gori D, Vo-Thanh G Beilstein Journal of Organic Chemistry, 2006 Link Archivováno 11. 10. 2006 na Wayback Machine
- Development of an unusually highly enantioselective hetero-Diels-Alder reaction of benzaldehyde with activated dienes catalyzed by hypercoordinating chiral aluminum complexes Simonsen KB1, Svenstrup N, Roberson M, Jorgensen KA. Chemistry. 2000 Jan;6(1):123-8. PMID 10747395
- Catalytic enantioselective aza-Diels-alder reactions of imines--an approach to optically active nonproteinogenic alpha-amino acids Yao S, Saaby S, Hazell RG, Jorgensen KA. Chemistry. 2000 Jul 3;6(13):2435-48. PMID 10939745
- Total syntheses of the Securinega alkaloids (+)-14,15-dihydronorsecurinine, (−)-norsecurinine, and phyllanthine. Han G, LaPorte MG, Folmer JJ, Werner KM, Weinreb SM. J Org Chem. 2000 Oct 6;65(20):6293-306. PMID 11052071
- Racemic and asymmetric Diels-Alder reactions of 1-(2-oxazolidinon-3-yl)-3-siloxy-1,3-butadienes. Janey JM, Iwama T, Kozmin SA, Rawal VH.J Org Chem. 2000 Dec 29;65(26):9059-68.PMID 11149852
- Total asymmetric synthesis of the putative structure of the cytotoxic diterpenoid (−)-sclerophytin a and of the authentic natural sclerophytins A and B. Bernardelli P, Moradei OM, Friedrich D, Yang J, Gallou F, Dyck BP, Doskotch RW, Lange T, Paquette LA. J Am Chem Soc. 2001 Sep 19;123(37):9021-32. DOI:10.1021/ja011285y
- A straightforward stereoselective synthesis of D- and L-5-hydroxy-4-hydroxymethyl-2-cyclohexenylguanine. Wang J, Morral J, Hendrix C, Herdewijn P.J Org Chem. 2001 Dec 14;66(25):8478-82. DOI:10.1021/jo015924z
- Chiral hetero Diels-Alder products by enantioselective and diastereoselective zirconium catalysis. Scope, limitation, mechanism, and application to the concise synthesis of (+)-Prelactone C and (+)-9-deoxygoniopypyrone. Yamashita Y, Saito S, Ishitani H, Kobayashi S.J Am Chem Soc. 2003 Apr 2;125(13):3793-8. DOI:10.1021/ja028186k
- Enantioselective catalysis of hetero Diels-Alder reaction and diethylzinc addition using a single catalyst. Du H, Ding K.Org Lett. 2003 Apr 3;5(7):1091-3. DOI:10.1021/ol034143c
- Asymmetric hetero Diels-Alder reactions of Danishefsky's diene and glyoxylate esters catalyzed by chiral bisoxazoline derived catalysts Arun K. Ghosh, Packiarajan Mathivanan, John Cappiello, K. Krishnan Tetrahedron: Asymmetry Volume 7, Issue 8, August 1996, Pages 2165–2168 DOI:10.1016/0957-4166(96)00261-3
- Asymmetric Hetero-Diels–Alder Reaction of Danishefsky’s Dienes with α-Carbonyl Esters Catalyzed by an Indium(III)–PyBox Complex Bei Zhao and Teck-Peng Loh Organic Letters 2013 15 (12), 2914-2917 DOI:10.1021/ol400841s
- A Highly Enantioselective Hetero-Diels−Alder Reaction of Aldehydes with Danishefsky's Diene Catalyzed by Chiral Titanium(IV) 5,5‘,6,6‘,7,7‘,8,8‘-Octahydro-1,1‘-bi-2-naphthol Complexes Bin Wang, Xiaoming Feng, Yaozong Huang, Hui Liu, Xin Cui and Yaozhong Jiang The Journal of Organic Chemistry 2002 67 (7), 2175-2182 DOI:10.1021/jo016240u
- Zheng, J., Lin, L., Fu, K., Zhang, Y., Liu, X. and Feng, X. (2014), Asymmetric Hetero-Diels–Alder Reaction of Danishefsky’s Diene with α-Ketoesters and Isatins Catalyzed by a Chiral N,N′-Dioxide/Magnesium(II) Complex. Chem. Eur. J., 20: 14493–14498. DOI:10.1002/chem.201404144
- Difluorinated Danishefsky's diene: a versatile C(4) building block for the fluorinated six-membered rings. Amii H, Kobayashi T, Terasawa H, Uneyama K. Org Lett. 2001 Oct 4;3(20):3103-5. DOI:10.1021/ol0163631
Externí odkazy
 Obrázky, zvuky či videa k tématu Danishefského dien na Wikimedia Commons
Obrázky, zvuky či videa k tématu Danishefského dien na Wikimedia Commons

