1,4-diazabicyklo(2.2.2)oktan
1,4-Diazabicyklo[2.2.2]oktan, zkráceně DABCO, je bicyklická organická sloučenina se vzorcem N2(C2H4)3. Jedná se o silně nukleofilní terciární amin, používaný jako katalyzátor a reaktant při polymerizacích a v organické syntéze.[2]
| 1,4-diazabicyklo[2.2.2]oktan | |
|---|---|
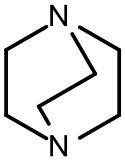
Strukturní vzorec | |
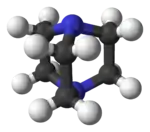
Model molekuly | |
| Obecné | |
| Systematický název | 1,4-diazabicyklo[2.2.2]oktan |
| Ostatní názvy | DABCO, triethylendiamin, TEDA |
| Sumární vzorec | C6H12N2 |
| Vzhled | bezbarvé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 280-57-9 |
| EC-no (EINECS/ELINCS/NLP) | 205-999-9 |
| PubChem | 9237 |
| ChEBI | 151129 |
| SMILES | C1CN2CCN1CC2 |
| InChI | 1S/C6H12N2/c1-2-8-5-3-7(1)4-6-8/h1-6H2 |
| Vlastnosti | |
| Molární hmotnost | 112,17 g/mol |
| Teplota tání | 158 °C (431 K)[1] |
| Teplota varu | 174 °C (447 K)[1] |
| Hustota | 1,14 g/cm3 (28 °C)[1] |
| Rozpustnost ve vodě | 45 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech |
13 g/100 g (aceton) 77 g/100 g (ethanol) 26,1 g/100 g (ethylmethylketon); rozpustný v chloroformu[1] |
| Rozpustnost v nepolárních rozpouštědlech |
51 g/100 g (benzen)[1] |
| Tlak páry | 99 Pa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H228 H302 H315 H318 H319 H335 H412[1] |
| P-věty | P210 P240 P241 P261 P264 P270 P271 P272 P273 P280 P301+312 P302+352 P304+340 P305+351+338 P310 P312 P321 P330 P332+313 P337+313 P362 P370+378 P403+233 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Chinuklidin má podobnou strukturu, která se liší pouze náhradou jednoho dusíkového atomu uhlíkem.
Reakce
pKa iontu [HDABCO]+ (protonované formy) je 8,8, což je podobná hodnota jako u běžných alkylaminů. Aminová skupina je silným nukleofilem, protože aminová centra nejsou stericky narušována. Zásaditost této sloučeniny dostačuje ke spouštění C–C párování koncových alkynů, například fenylacetylen reaguje s jodareny chudými na elektrony.
Katalyzátor
DABCO se používá jako zásaditý katalyzátor při:
- tvorbě polyuretanu z alkoholů a izokyanátových funkcionalizovaných monomerů.[3]
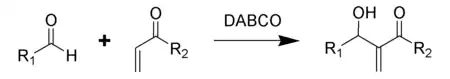
- Baylisových–Hillmanových reakcích aldehydů s nenasycenými aldehydy a ketony.[4]
Lewisovy zásady
DABCO je silným ligandem a Lewisovou zásadou. Vytváří krystalický 2:1 adukt s peroxidem vodíku[5] a s oxidem siřičitým.[6]
Tvorba iontových monomerů
DABCO lze použít k přípravě dvojnásobně nabitých styrenových monomerů. Tyto monomery umožňují tvorbu polyelektrolytů a ionomerů s dvěma cyklickými kvartérními amoniovými kationty na každé molekule.[7]
Zachytávání singletového kyslíku
DABCO a podobné aminy mohou zachytávat singletový kyslík, jsou tak účinnými antioxidanty[8] a lze je použít k prodloužení životnosti barviv. Díky tomu nachází DABCO využití v barvivových laserech a ve fluorescenčních mikroskopech.[9]
DABCO může též být použit při demethylacích kvartérních amoniových solí zahříváním v dimethylformamidu (DMF).[10]
Výroba
Dabco se vyrábí tepelnými reakcemi sloučenin typu H2NCH2CH2X (X = OH, NH2 nebo NHR) za katalýzy zeolity. Níže je uvedena rovnice přípravy z ethanolaminu:[11]
- 3 H2NCH2CH2OH → N(CH2CH2)3N + NH3 + 3 H2O
Odkazy
Literatura
- Cecchi, L.; DESARLO, F.; MACHETTI, F. 1,4-Diazabicyclo[2.2.2]octane (DABCO) as an Efficient Reagent for the Synthesis of Isoxazole Derivatives from Primary Nitro Compounds and Dipolarophiles: The Role of the Base. European Journal of Organic Chemistry. 2006, s. 4852–4860. DOI 10.1002/ejoc.200600475. (anglicky)
Reference
V tomto článku byl použit překlad textu z článku DABCO na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/9237
- Uppuluri V. Mallavadhani, Nicolas Fleury-Bregeot. „1,4-Diazabicyclo [2.2.2]octane“. In Encyclopedia of Reagents for Organic Synthesis, 2010, John Wiley & Sons, Ltd. DOI:10.1002/047084289X.rd010m.pub2
- Polyurethane additives guide [online]. Air Products & Chemicals. Dostupné v archivu pořízeném z originálu dne 2016-03-06.
- Baylis, A. B.; Hillman, M. E. D. German Patent 2155113, 1972
- P. Dembech, A. Ricci, G. Seconi, and M. Taddei „Bis(trimethylsilyl) Peroxide“ Organic Syntheses 1997, volume 74, pp. 84. DOI:10.15227/orgsyn.074.0084
- Ludovic Martial and Laurent Bischoff „Preparation of DABSO from Karl-Fischer Reagent“ Organic Syntheses 2013, volume 90, pp. 301. DOI:10.15227/orgsyn.090.0301
- K. Zhang; K. J. Drummey; N. G. Moon; W. D. Chiang; T. E. Long. Styrenic DABCO salt-containing monomers for the synthesis of novel charged polymers. Polymer Chemistry. 2016, s. 3370–3374. Dostupné online. DOI 10.1039/C6PY00426A.
- C. Ouannes; T. Wilson. Quenching of singlet oxygen by tertiary aliphatic amines. Effect of DABCO (1,4-diazabicyclo[2.2.2]octan). Journal of the American Chemical Society. 1968, s. 6527–6528. Dostupné online. DOI 10.1021/ja01025a059.
- K. Valnes; P. Brandtzaeg. Retardation of immunofluorescence fading during microscopy. Journal of Histochemistry and Cytochemistry. 1985, s. 755–761. Dostupné v archivu pořízeném dne 2015-05-13. DOI 10.1177/33.8.3926864. PMID 3926864. Archivováno 13. 5. 2015 na Wayback Machine
- T. L. Ho. Dealkylation of Quaternary Ammonium Salts with 1,4-Diazabicyclo[2.2.2]octane. Synthesis. 1985, s. 755–761. Dostupné v archivu pořízeném dne 2015-05-13. DOI 10.1055/s-1972-21977. Archivováno 13. 5. 2015 na Wayback Machine
- Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke „Amines, Aliphatic“ in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI:10.1002/14356007.a02_001