Cyklopropenium
Cyklopropeniový ion je kation se vzorcem C3H +
3 , jde o nejjednodušší aromatický kation. Byly izolovány jeho soli a také, pomocí rentgenové krystalografie, popsána struktura řady jeho derivátů. Tento ion i několik jednodušších derivátů byly nalezeny v atmosféře Saturnova měsíce Titanu.[1]
Struktura
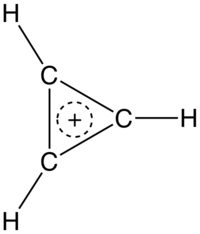
Se dvěma π elektrony cyklopropeniové katiponty odpovídají Hückelovu pravidlu aromaticity pro 4n+2 elektronů, zde n = 0. C3H3 jádro je rovinné a všechny vazby C–C jsou stejné; například kation u [C3(SiMe3)3]+SbCl −
6 ,[2] vzdálenosti C–C v kruhu se pohybují mezi 137,4(2) a 139,2(2) pm.
6
Příprava
Byly popsány soli mnoha cyklopropenylových kationtů; jejich stabilita závisí na sterických a indukčních efektech substituentů.
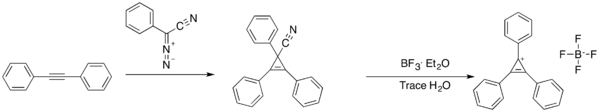
Sůl trifenylcyklopropenia jako první popsal Ronald Breslow v roce 1957. Získal ji ve dvou krocích, kdy nejprve provedl reakci fenyldiazoacetonitrilu s difenylacetylenem za vzniku 1,2,3-trifenyl-2-cyklopropennitrilu. Tutto látku poté nechal zreagovat s fluoridem boritým za vzniku [C3Ph3]BF4.[3][4][5]
Zdrojový kation, [C3H3]+, byl popsán v podobě soli s hexachloroantimoničnanovýmaniontem (SbCl −
6 ), a to v roce 1970;[6] při −20 °C je neomezeně stálý.
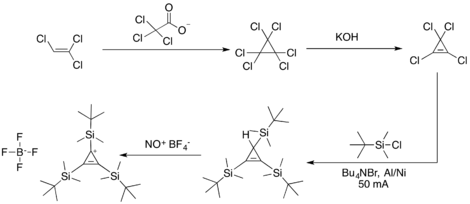
Soli trichlorcyklopropenia lze připravit odtržením chloridového iontu z tetrachlorcyklopropenu:[7]
- C3Cl4 + AlCl3 → [C3Cl3]+AlCl −
4
Tetrachlorcyklopropen může být převeden na tris(terc-butyldimethylsilyl)cyklopropen. odštěpenímn hydridu s použitím tetrafluorboritanu nitrosonia se vytváří trisilylovaný cyklopropeniový kation.[8]
Aminované cyklopropenové soli jsou poměrně stálé.[9][10]
Kalicen je neobvyklým derivátem, jenž má cyklopropeniový ion propojený s cyklopentadienylovým.
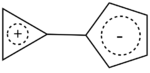 Kalicen obsahuje cyklopropeniový kruh.
Kalicen obsahuje cyklopropeniový kruh.
Reakce
Organická chemie
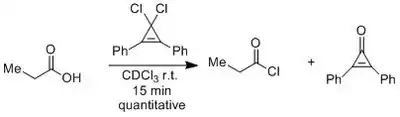
Chloridy esterů cyklopropenia jsou meziprodukty při používání dichlorcyklopropenů k přeměně karboxylových kyselin na acylchloridy:[11]
Podobné cyklopropeniové ionty vznikají při obnovování 1,1-dichlorcyklopropenů z cyklopropenonů.
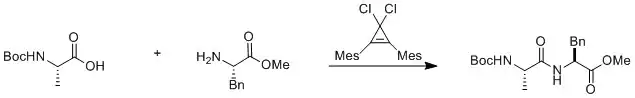
Cyklopropeniumchloridy byly také využity k tvorbě peptidových vazeb,[11] například na následujícím obrázku je znázorněna reakce aminokyseliny (chráněné boc) s nechráněnou aminokyselinou, cyklopropenium umožňuje vznik peptidové vazby přes tvorbu acylchloridu následovanou nukleofilní substituční reakcí s aminokyselinou.
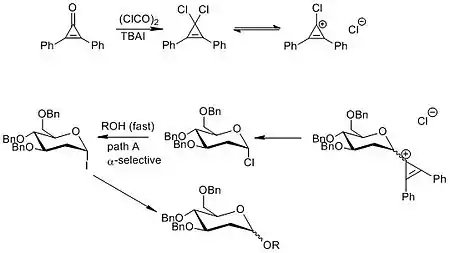
Tento způsob vytváření acylchloridů může být také využit k přípravě alfa-anomerních monosacharidů.[12]
Po použití cyklopropeniového iontu k získání chloridu na anomerním uhlíku je sloučenina jodována tetrabutylamoniumjodidem. Navázaný jod lze následně nahradit ROH skupinou a rychle tak alfa-selektivně vytvořit sacharid.
Je popsáno několik syntetických postupů využívajících otevírání cyklopropeniových kruhů za vzniku allylkarbenových kationtů. Produkt lineární degradace obsahuje jak nukleofilní, tak i elektrofilní atomy uhlíku.[13]
Organokovové sloučeniny
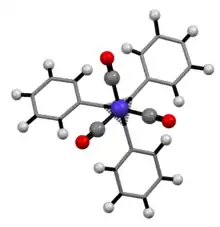
Je popsán velký počet komplexů s cyklopropeniovými ligandy, například [M(C3Ph3)(PPh3)2]+ (M = Ni, Pd, Pt) a Co(C3Ph3)(CO)3. Tyto sloučeniny se připravují reakcemi cyklopropeniových solí s komplexy kovů v nízkých oxidačních číslech.[14]
Polyelektrolyty
Protože je známo mnoho jejich substituovaných derivátů, tak jsou cyklopropeniové soli předměty zájmu pro možné využití v polyelektrolytech, používaných například v rámci odsolování vody a v palivových článcích. Obzvláště vyhledávané jsou, díky své značné stálosti, tris(dialkylamino)cyklopropeniové soli.[15]
Odkazy
Související články
- Fosfirenium
Reference
V tomto článku byl použit překlad textu z článku Cyclopropenium ion na anglické Wikipedii.
- A.Aliab, C.Puzzarinid, "Cyclopropenyl cation – the simplest Huckel's aromatic molecule – and its cyclic methyl derivatives in Titan's upper atmosphere", Planetary and Space Science,Volume 87, October 2013, Pages 96-105 https://doi.org/10.1016/j.pss.2013.07.007
- A. De Meijere, D. Faber, M. Noltemeyer. R. Boese, T. Haumann, T. Muller, M. Bendikov, E. Matzner, Y. Apeloig. Tris(trimethylsilyl)cyclopropenylium Cation: The First X-ray Structure Analysis of an α-Silyl-Substituted Carbocation. The Journal of Organic Chemistry. 1996, s. 8564. DOI 10.1021/jo960478e.
- Arvind Yadav. Cyclopropenium Ion. Synlett. 2012, s. 2428–2429. DOI 10.1055/s-0032-1317230.
- Ronald Breslow. Synthesis of the s-Triphenylcyclopropenyl Cation. Journal of the American Chemical Society. 1957, s. 5318. DOI 10.1021/ja01576a067.
- Ruo Xu; Ronald Breslow. 1,2,3-Triphenylcyclopropenium Bromide. Organic Syntheses. 1997, s. 72. DOI 10.15227/orgsyn.074.0072.
- R. Breslow; J. T. Groves. Cyclopropenyl Cation. Synthesis and Characterization. Journal of the American Chemical Society. 1970, s. 984–987. DOI 10.1021/ja00707a040.
- C. Glück; V. Poingée; H. Schwager. Improved Synthesis of 7,7-Difluorocyclopropabenzene. Synthesis. 1987, s. 260–262. DOI 10.1055/s-1987-27908.
- Herwig Buchholz; G. K. Surya Prakash; Denis Deffieux; George Olah. Electrochemical preparation of tris(tert-butyldimethylsilyl)cyclopropene and its hydride abstraction to tris(tert-butyldimethylsilyl)cyclopropenium tetrafluoroborate. Proceedings of the National Academy of Sciences of the United States of America. 1999, s. 10003-10005. Dostupné online. DOI 10.1073/pnas.96.18.10003. PMID 10468551. Bibcode 1999PNAS...9610003B.[nedostupný zdroj]
- Jeffrey S. Bandar; Tristan H. Lambert. Aminocyclopropenium ions: synthesis, properties, and applications. Synthesis. 2013, s. 2485–2498. DOI 10.1055/s-0033-1338516.
- Michael M. Haley; Robert D. Gilbertson; Timothy J. D. Weakley. Preparation, X-ray Crystal Structures, and Reactivity of Alkynylcyclopropenylium Salts. Journal of Organic Chemistry. 2000, s. 1422–1430. DOI 10.1021/jo9915372. PMID 10814104.
- David J. Hardee; Lyudmila Kovalchuke; Tristan H. Lambert. Nucleophilic Acyl Substitution via Aromatic Cation Activation of Carboxylic Acids: Rapid Generation of Acid Chlorides under Mild Conditions. Journal of the American Chemical Society. 2010, s. 5002–5003. DOI 10.1021/ja101292a. PMID 20297823.
- J. M. Nogueira; S. H. Nguyến; C. S. Bennett. Cyclopropenium Cation Promoted Dehydrative Glycosylations Using 2-Deoxy- and 2,6-Dideoxy-Sugar Donors. Journal of the American Chemical Society. 2011, s. 2184–2187. DOI 10.1021/ol200726v. PMID 21548642.
- Zen'ichi Yoshida; Shigeo Yoneda; Hideo Hirai. A Novel Synthesis of Pyrroles by the Reactions of Tris(alkylthio)cyclopropenium Salt with Amines. Heterocycles. 1981, s. 865. DOI 10.3987/S-1981-02-0865.
- T. Chiang; R. C. Kerber; S. D. Kimball; J. W. Lauher. (η3-Triphenylcyclopropenyl) Tricarbonylcobalt. Inorganic Chemistry. 1979, s. 1687–1691. DOI 10.1021/ic50196a058.
- JIANG, Yivan; FREYER, Jessica; COTANDA, Pepa; BRUCKS, Spencer; KILLOPS, Kato; BANDAR, Jeffrey; TORSITANO, Christopher. The evolution of cyclopropenium ions into functional polyelectrolytes. Nature Communications. 2015, s. 1–7. Dostupné online. DOI 10.1038/ncomms6950. PMID 25575214. Bibcode 2015NatCo...6E5950J. (anglicky)