Chlorid nikelnatý
Chlorid nikelnatý (chemický vzorec NiCl2) je v bezvodém stavu zlatožlutá hygroskopická práškovitá látka a v závislosti na hydrataci se mění jeho barva, je dobře rozpustný ve vodě a také methanolu, ethanolu, glycerolu a diethyletheru. Dihydrát tvoří hnědožluté, tetrahydrát žlutozelené a hexahydrát sytě zelené krystaly. V přírodě se vzácně vyskytuje v podobě hexahydrátu jako minerál niklbischofit. Chlorid nikelnatý je výchozí sloučeninou pro další nikelnaté sloučeniny i chemické syntézy. Stejně jako další sloučeniny niklu je karcinogenní.
| Chlorid nikelnatý | |
|---|---|

Prášková forma | |

Krystalická forma | |
| Obecné | |
| Systematický název | Chlorid nikelnatý |
| Anglický název | Nickel(II) chloride |
| Německý název | Nickel(II)-chlorid |
| Sumární vzorec | NiCl2 |
| Vzhled | zlatožlutý prášek hnědožluté krystaly (dihydrát) žlutozelené krystaly (tetrahydrát) zelené krystaly (hexahydrát) |
| Identifikace | |
| Registrační číslo CAS | 7718-54-9 |
| 7791-20-0 (hexahydrát) | |
| PubChem | 24385 |
| Číslo RTECS | QR6480000 |
| Vlastnosti | |
| Molární hmotnost | 129,60 g/mol 165,63 g/mol (dihydrát) 201,66 g/mol (tetrahydrát) 237,69 g/mol (hexahydrát) |
| Teplota tání | 1 009 °C (196 kPa) 80 °C (hexahydrát) |
| Teplota sublimace | 970 °C |
| Hustota | 3,508 g/cm3 2,56 g/cm3 (dihydrát) 2,217 g/cm3 (20 °C, tetrahydrát) 1,921 g/cm3 (20 °C, hexahydrát) |
| Index lomu | dihydrát nDa= 1,620 nDb= 1,723 nDc= 1,783 hexahydrát nD= 1,57 |
| Rozpustnost ve vodě | 53,4 g/100 g (0 °C) 65,6 g/100 g (25 °C) 76,0 g/100 g (50 °C) 86,2 g/100 g (75 °C) 87,6 g/100 g (100 °C) dihydrát 143,52 g/100 g (70 °C) 144,32 g/100 g (80 °C) 146,87 g/100 g (100 °C) tetrahydrát 184,88 g/100 g (30 °C) 190,13 g/100 g (40 °C) 233,47 g/100 g (60 °C) hexahydrát 174,5 g/100 g (0 °C) 475,5 g/100 g (60 °C) 596 g/100 g (100 °C) |
| Rozpustnost v polárních rozpouštědlech |
methanol ethanol glycerol diethylether |
| Měrná magnetická susceptibilita | 590×10−6 cm3g−1 220×10−6 cm3g−1 (hexahydrát) |
| Struktura | |
| Krystalová struktura | klencová jednoklonná tělesně centrovaná (dihydrát) čtverečná (tetrahydrát) jednoklonná bazálně centrovaná (hexahydrát) |
| Hrana krystalové mřížky | a= 613 pm α= 33°36´ dihydrát a= 697 pm b= 690 pm c= 881 pm β= 91°30´ tetrahydrát a= 662 pm c= 1 323 pm hexahydrát a= 1 023 pm b= 705 pm c= 657 pm β= 122°10´ |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −316,1 kJ/mol −924,4 kJ/mol (dihydrát) −1 527,0 kJ/mol (tetrahydrát) −2 116,2 kJ/mol (hexahydrát) |
| Entalpie rozpouštění ΔHrozp | −642 J/g |
| Entalpie sublimace ΔHsub | 1 737 J/g |
| Standardní molární entropie S° | 98,07 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −272,6 kJ/mol |
| Izobarické měrné teplo cp | 0,533 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R23/25, R38, R42/43, R48/23, R49, R50/53, R61, R68 |
| S-věty | S45, S53, S60, S61 |
| NFPA 704 |  0
2
0
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Chlorid nikelnatý se získává promýváním zbytků po výrobě niklu kyselinou chlorovodíkovou a průmyslově potom přímou syntézou chloru a niklu.
- Ni + Cl2 → NiCl2
Pro získání bezvodé soli z hexahydrátu nelze využít tepelnou dehydrataci. Nejvýhodnější je vysušit ho pomocí thionylchloridu SOCl2 za tepla nebo za zahřívání v proudu plynného chlorovodíku HCl:
- NiCl2·6 H2O + 6 SOCl2 → NiCl2 + 6 SO2 + 12 HCl
Dehydratace je doprovázena změnou barvy ze zelené na žlutou.
Využití
Chlorid nikelnatý a jeho hydráty se využívají v organické syntéze:
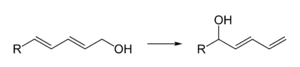
- Jako slabá Lewisova kyselina např. pro regioselektivní izomeraci dienolů:
- V kombinaci s chloridem chromnatým CrCl2 pro reakci aldehydů s vinyljodidem za vzniku allylových alkoholů.
- Pro bezproudé niklování železa a oceli, mědi a mosazi.
- Selektivní snížení přítomnosti tetrahydridohlinitanu lithného LiAlH4, např. pro konverzi alkenů na alkany.
- Jako prekurzor „boridu niklu“, připravený přímo v reakční směsi z NiCl2 a NaBH4. Toto činidlo se chová jako Raneyův nikl a stejně jako on má také vysokou katalyzační schopnost pro hydrogenaci nenasycených karbonylových sloučenin.
- V jemně práškové podobě niklu získané redukcí zinkem jako prekurzor k redukci aldehydů, alkenů a nitroaromatických sloučenin. Toto činidlo také umožňuje reakce dvou alkylhalogenidů – 2RX → RR, kde R = aryl, vinyl.
- Jako katalyzátor pro výrobu dialkylarylfosfátů z fosfitů a aryljodidu:
- ArI + P(OEt)3 → ArP(O)(OEt)2 + EtI
Reference
V tomto článku byl použit překlad textu z článku Nickel(II) chloride na anglické Wikipedii.
- Nickel chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid nikelnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid nikelnatý na Wikimedia Commons