1,2-bis(difenylfosfino)ethan
1,2-bis(difenylfosfino)ethan (zkráceně dppe) je organická sloučenina se vzorcem (Ph2PCH2)2 (Ph = fenyl). Používá se v koordinační chemii jako bidentátní ligand. Jedná se o bílou pevnou látku rozpustnou v organických rozpouštědlech.
| 1,2-bis(difenylfosfino)ethan | |
|---|---|

Strukturní vzorec | |
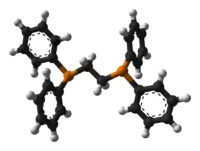
Model molekuly | |
| Obecné | |
| Systematický název | (ethan-1,2-diyl)bis(difenylfosfan) |
| Ostatní názvy | dppe |
| Funkční vzorec | [(C6H5)2PCH2]2 |
| Sumární vzorec | C26H24P2 |
| Identifikace | |
| Registrační číslo CAS | 1663-45-2 |
| EC-no (EINECS/ELINCS/NLP) | 216-769-2 |
| PubChem | 74267 |
| ChEBI | 30669 |
| SMILES | P(c1ccccc1)(c2ccccc2)CCP(c3ccccc3)c4ccccc4 |
| InChI | 1S/C26H24P2/c1-5-13-23(14-6-1)27(24-15-7-2-8-16-24)21-22-28(25-17-9-3-10-18-25)26-19-11-4-12-20-26/h1-20H,21-22H2 |
| Vlastnosti | |
| Molární hmotnost | 398,42 g/mol |
| Teplota tání | 140 až 142 °C (413 až 415 K) |
| Bezpečnost | |
| [1] | |
| H-věty | H315 H319 H335 H400 H410[1] |
| P-věty | P261 P264 P271 P273 P280 P302+352 P304+340 P305+351+338 P312 P321 P332+313 P337+313 P362 P391 P403+233 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
Příprava dppe začíná alkylací difenylfosfidu sodného, NaPPh2:[2][3]
- P(C6H5)3 + 2 Na → NaP(C6H5)2 + NaC6H5
NaC6H5, snadno oxidovatelný na vzduchu, následně reaguje s 1,2-dichlorethanem (ClCH2CH2Cl) na dppe:
- 2 NaC6H5 + ClCH2CH2Cl → (C6H5)2PCH2CH2P(C6H5)2 + 2 NaCl
Reakce
Redukcí dppe lithiem vzniká PhHP(CH2)2PHPh.[4]
- Ph2P(CH2)2PPh2 + 4 Li → PhLiP(CH2)2PLiPh + 2 PhLi
Hydrolýzou vzniká bis(sekundární fosfin):
- PhLiP(CH2)2PLiPh + 2 PhLi + 4H2O → PhHP(CH2)2PHPh + 4 LiOH + 2 C6H6
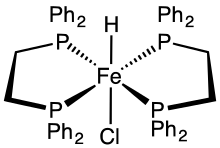 Bis(dppe) komplex HFeCl(dppe)2 je jedním z nejlépe dostupných hydridů přechodnýcjh kovů.
Bis(dppe) komplex HFeCl(dppe)2 je jedním z nejlépe dostupných hydridů přechodnýcjh kovů.
Reakcí dppe s oxidačními činidly, jako je peroxid vodíku nebo vodný roztok bromu vzniká jako důsledek neselektivní oxidace dppeO (s malými výtěžnostmi, například 13 %).[5] Selektivně lze dppe oxidovat pomocí PhCH2Br.
Ph2P(CH2)2PPh2 + PhCH2Br → Ph2P(CH2)2PPh2(CH2Ph)+Br−
Hydrogenace dppe dává ligand bis(dicyklohexylfosfino)ethan.
Komplexy
Je známo velké množství komplexů dppe, přičemž některé z nich se používají jako homogenní katalyzátory. Dppe téměř vždy funguje jako chelatující ligand, i když jsou také popsány komplexy, ve kterých je monodentátní (například W(CO)5(dppe))nebo tvoří můstek.[6]
Odkazy
Související články
- 1,2-Bis(dimethylfosfino)ethan
- Bis(difenylfosfino)methan
Reference
V tomto článku byl použit překlad textu z článku 1,2-Bis(diphenylphosphino)ethane na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/74267
- W. Hewertson; H. R. Watson. The preparation of di- and tri-tertiary phosphines. Journal of the Chemical Society. 1962, s. 1490–1494. DOI 10.1039/JR9620001490.
- Girolami, G.; Rauchfuss, T.; Angelici, R. Synthesis and Technique in Inorganic Chemistry, 3rd ed.; University Science Books: Sausalito, CA, 1999; pp. 85-92. ISBN 0-935702-48-2
- J. Dogan; J. B. Schulte; G. F.Swiegers; S. B. Wild. Mechanism of Phosphorus-Carbon Bond Cleavage by Lithium in Tertiary Phosphines. An Optimized Synthesis of 1, 2-Bis (phenylphosphino) ethane. The Journal of Organic Chemistry. 2000, s. 951–957. DOI 10.1021/jo9907336. PMID 10814038.
- Encyclopedia of Reagents for Organic Synthesis 2001 John Wiley & Sons, Ltd
- Cotton, F.A.; Wilkinson, G. Advanced Inorganic Chemistry: A Comprehensive Text, 4th ed.; Wiley-Interscience Publications: New York, NY, 1980; p.246. ISBN 0-471-02775-8

