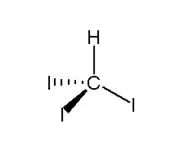
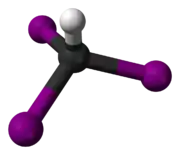
Trijódmetán
Trijódmetán alebo jodoform (CHI3) je žltý až žltozelený prášok alebo kryštalická pevná látka, s prenikavou až nepríjemnou vôňou, ktorá sa hojne používa v lekárstve. Vzniká napríklad reakciou etanolu s jódom v prítomnosti zásady. Má antiseptické (dezinfekčné) vlastnosti.
| Trijódmetán | |||||||||||||||||||||||||||||||||||
 Trijódmetán | |||||||||||||||||||||||||||||||||||
 Trijódmetán | |||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||
| Sumárny vzorec | CHI3 | ||||||||||||||||||||||||||||||||||
| Synonymá | Jodoform | ||||||||||||||||||||||||||||||||||
| Vzhľad | Žltý až žltozelený prášok alebo kryštalická pevná látka, s prenikavou až nepríjemnou vôňou | ||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 393,8 u | ||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 393,73 g/mol | ||||||||||||||||||||||||||||||||||
| Teplota topenia | 123 °C | ||||||||||||||||||||||||||||||||||
| Teplota rozkladu | 217 °C (výbuch) | ||||||||||||||||||||||||||||||||||
| Hustota | 4,008 g/cm3 | ||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: 0,01 g/100 ml (20 °C) | ||||||||||||||||||||||||||||||||||
| Teplota vzplanutia | 204 °C | ||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||
| Číslo CAS | 75-47-8 | ||||||||||||||||||||||||||||||||||
| EINECS číslo | 200-874-5 | ||||||||||||||||||||||||||||||||||
| Číslo RTECS | PB7000000 | ||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||

Syntéza a reakcie
Syntéza trijódmetánu bola prvýkrát popísaná v roku 1822 Georgesom Serrulasom, ako reakcia par jódu s vodnou parou cez rozžeravené uhlie, a tiež reakciu etoxidu draselného s jódom za prítomnosti vody. Súčasne a nezávisle od neho tím Johna Thomasa Coopera syntetizoval trijódmetán haloformovou reakciou jódu a hydroxidu sodného s jednou z týchto štyroch druhov organických zlúčenín: metylketónu (CH3COR), acetaldehydu (CH3CHO), etanolu (CH3CH2OH), a určitých sekundárnych alkoholov (CH3CHROH, kde R je alkylová alebo arylová skupina).
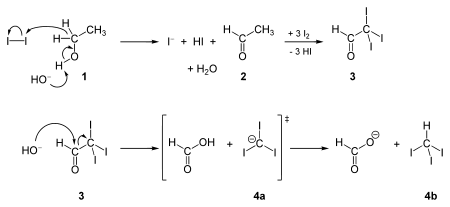
Reakcia jódu zo základnými metylketónmi je spoľahlivý test trijódmetánu (objaví sa žltá zrazenina) na prítomnosť metylketónu v zlúčenine. Trijódmetán sa používa aj na testovanie prítomnosti sekundárnych alkoholov ako sú metylalkoholy.
Niektoré reagencie (napr. jodovodík) dokážu previesť trijódmetán, na dijódmetán. Konverziou s oxidom uhličitým, je umožnené trijódmetánu reagovať s vodným roztokom dusičnanu strieborného za vzniku oxidu uhoľnatého. Ak sa nechá reagovať práškové elementárne striebro s trijódmetánom, je znížená produkcia acetylénu. Pri zahrievaní sa trijódmetán rozkladá za vzniku molekúl jódu, uhlíka a plynného jodovodíka.
Pozri aj
- Tribrómmetán
- Trifluórmetán
- Trichlórmetán
Zdroj
Tento článok je čiastočný alebo úplný preklad článkov Jodoform na českej Wikipédii a Iodoform na anglickej Wikipédii.
| Chemický portál Medicínsky portál |


