Kyselina izokyanatá
Kyseliny izokyanatá (HNCO) je anorganická zlúčenina objavená roku 1830 Justusom von Liebigom a Friedrichom Wöhlerom, je to nestála a jedovatá, bezfarebná kvapalina.
| Kyselina izokyanatá | |||||||||||||||||||||||||||||
 Kyselina izokyanatá | |||||||||||||||||||||||||||||
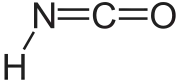 Kyselina izokyanatá | |||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||
| Sumárny vzorec | HNCO | ||||||||||||||||||||||||||||
| Synonymá | Izokyanát vodíka | ||||||||||||||||||||||||||||
| Vzhľad | Bezfarebná kvapalná alebo plynná látka | ||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||
| Molekulová hmotnosť | 43,0 u | ||||||||||||||||||||||||||||
| Molárna hmotnosť | 43,025 g/mol | ||||||||||||||||||||||||||||
| Teplota topenia | −86,8 °C | ||||||||||||||||||||||||||||
| Teplota varu | 23,5 °C | ||||||||||||||||||||||||||||
| Hustota | 1,14 g/cm3 (0 °C) | ||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: málo rozpustná v polárnych rozpúšťadlách: alkoholoch v nepolárnych rozpúšťadlách: éteroch kvapalných uhľovodíkov | ||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | -147 kJ/mol | ||||||||||||||||||||||||||||
| Štandardná entropia | 182 J K−1 mol−1 | ||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | -121 kJ/mol | ||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||
| Číslo CAS | 75-13-8 | ||||||||||||||||||||||||||||
| EINECS číslo | 616-189-3 | ||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||
Príprava a reakcie
Kyselinu izokyanatú možno pripraviť protonizáciou kyanatanového aniónu (OCN-), napríklad pridaním kyseliny chlorovodíkovej (HCl) do roztoku kyanatanu draselného (KOCN). V takto pripravenej kyseline izokyanatej je v množstve okolo 3 % prítomná pravdepodobne kyselina kyantá (HOCN), nemožno ju však izolovať (pozri nižšie)[1].
- H+ + OCN- → HNCO
Kyselinu izokyanatú možno tiež pripraviť vysokoteplotným rozkladom kyseliny kyanúrovej, ktorá časom vzniká v koncentrovaných roztokoch kyseliny izokyanatej. Je to jej trimér.
- C3H3N3O3 -t → 3 HNCO
Kyselina izokyanatá vo vode pomaly hydrolyzuje za vzniku oxidu uhličitého (CO2) a čpavku (NH3).
- HNCO + H2O → CO2 + NH3
S amínmi reaguje za vzniku karbamidov a reakcia sa nazýva karbamylácia.
- HNCO + RNH2 → RNHC(O)NH2.
Izoméry
Nízkoteplotnou fotolýzou pevných látok obsahujúcich kyselinu izokyanatú bola preukázaná existencia molekuly H-O-C≡N (kyselina kyantá), ktorá je tautomérom kyseliny izokyanatej.[2] Čistá kyselina kyanatá nebola izolovaná a kyselina izokyanatá v roztokoch vo všetkých rozpúšťadlách výrazne prevažuje.[3] Je preto potrebné dávať pozor, pretože v niektorých príručkách sa vyskytujú údaje pre kyselinu kyanatú, ale v skutočnosti ide o kyselinu izokyanátú.
Ďalším izomérom je kyselina fulmínová (H-C=N-O), ktorá však nie je nijak zvlášť stabilná.[4]
Referencie
- GREENWOOD, Norman Neill; EARNSHAW, Alan. Chemie prvků I. 1. vyd. Praha : Informatorium, 1993. ISBN 80-85427-38-9. S. 361.
- JACOX, Marilyn Esther; MILLIGAN, Dolphus Edward. Low-Temperature Infrared Study of Intermediates in the Photolysis of HNCO and DNCO. Journal of Chemical Physics, 1964, s. 2457–2460. DOI: 10.1063/1.1725546. (po anglicky)
- NARULA, Acharan S.; RAMACHANDRAN, Kishore. Isocyanic Acid. Encyclopedia of Reagents for Organic Synthesis (New York, USA: John Wiley & Sons), 2001. DOI: 10.1002/047084289X.ri072m. (po anglicky)
- Kurzer, Frederick. Fulminic Acid in the History of Organic Chemistry. Journal of Chemical Education, 2000, s. 851–857. DOI: 10.1021/ed077p851.
Literatúra
- VOHLÍDAL, Jiří; JULÁK, Alois; ŠTULÍK, Karel. Chemické a analytické tabulky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Kyselina isokyanatá na českej Wikipédii.





