Tautoméria
Tautoméry sú štruktúrne izoméry (konštitučné izoméry) chemických zlúčenín, ktoré môžu voľne prechádzať z jedného na druhý. [1][2][3][4] Táto reakcia je zvyčajne výsledkom presunu protónu (vodíkového katiónu). Tento dej je dôležitý napríklad v chovaní aminokyselín alebo nukleových kyselín, základných výstavbových molekúl živých systémov.

Chemická reakcia, pri ktorej sa premieňa jeden tautomér na druhý, sa nazýva tautomerizácia. Tento koncept sa nazýva tautoméria. Zriedka sa nazýva dezmotropia (kedy sú oba tautoméry stabilné a možno ich vyizolovať z roztoku).
Tautoméria by nemala byť zamieňaná s rezonančnými štruktúrami. Tautoméry sú odlišné zlúčeniny, ktoré možno identifikovať podľa rôznych vlastností (napríklad spektroskopických)[5]. Naproti tomu rezonančné štruktúry umožňujú vysvetliť chovanie či vlastnosti molekúl, ale neexistujú ako samostatné molekuly.
Príklady
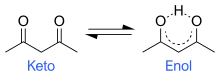
Tautoméria je všadeprítomná v organickej chémii. Zvyčajne je asociovaná s polárnymi molekulami a iónmi obsahujúcimi funkčné skupiny, ktoré sú aspoň slabo kyslé. Tautoméry existujú väčšinou v pároch, čo znamená, že sa protón presúva medzi dvoma miestami v molekule. Typicky je to zmena spojená s pohybom dvojitej väzby: H−X−Y=Z ⇌ X=Y−Z−H. Bežné páry tautomérov zahŕňajú:[6]
- ketón - enol: H−O−C=C ⇌ O=C−C−H, takzvaná keto-enol tautoméria
- imín - enamín: N=C−C−H ⇌ H−N−C=C
- kyanamid - karbodiimid
- guanidín - guanidín - guanidín: guanidínová skupina má uhlíkový atóm, na ktorý sú naviazané tri dusíkové skupiny - umožňuje teda presun v troch rôznych orientáciách
- amid - imidová kyselina: H−N−C=O ⇌ N=C−O−H (imidová kyselina vzniká napríklad pri hydrolýze nitrilov)
- laktam - laktim: cyklická forma tautomérie amid-imidovej kyseliny v 2-pyridóne a podobných štruktúrach, ako sú napríklad báze nukleových kyselín (guanín, tymín, cytozín a uracil)
- imín - imín: R1R2C(=NCHR3R4) ⇌ (R1R2CHN=)CR3R4, napríklad pri enzýmových reakciách s pyridoxalfosfátom
- nitro - aci-nitro (nitrónová kyselina): RR'HC–N+(=O)(O–) ⇌ RR'C=N+(O–)(OH)
- nitrózo – oxim: H−C−N=O ⇌ C=N−O−H
- ketén - ynol: H−C=C=O ⇌ C≡C−O−H, reakcie sa účastní trojitá väzba
- fosfát - fosfonát: P(OR)2(OH) ⇌ HP(OR)2(=O), zmena trojväzbového fosforu na päťväzbový
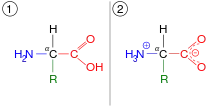
- aminokyselina - karboxylát amónny: H2N−CH2−COOH ⇌ H3N+
−CH2−CO−
2, reakcia je bežná pre aminokyseliny (základné stavebné bloky bielkovín). Protón sa presúva o viac ako dva atómy ďalej, čím vzniká zwitterión namiesto presunu dvojitej väzby
Prototropia
Prototopia je najbežnejší druh tautomérie, počas ktorej sa presúva protón.[7] Prototropická tautoméria sa dá považovať za časť acidobazického chovania látok. Tieto tautoméry sú sadami izomérnych protónovaných štruktúr s rovnakým sumárnym vzorcom a celkovým nábojom. Tautomérizácia môže byť katalyzovaná:
- kyselinou, pozostávajúc z krokov: protonácia, vytvorenie delokalizovaného katiónu a deprotonácia na inom mieste vedľa katiónu
- bázou (zásadou), pozostávajúc z krokov: deprotonácia, vytvorenie delokalizovaného aniónu (napr. enolátu) a protonácia na inom mieste vedľa aniónu
Dve špecifické podkategórie tautomatizácie sú:
- Anulárna tautomerizácia je druh prototropickej tautomérie, počas ktorej sa môže protón nachádzať na viacerých pozíciach v heterocylickom systéme, ako je napríklad 1H- and 3H-imidazol, 1H-, 2H- and 4H-1,2,4-triazol, 1H- and 2H-izoindol.[8]
- Tautoméria, pri ktorej je pohyb protónu spojený so zmenou tvaru molekuly z reťazca na kruh. Príkladom je napríklad zmena tvaru cukrov z otvoreného reťazca na hemiacetálový kruh, typická pre pyranózy a furanózy. Táto tautoméria by sa dala zapísať ako H−O ⋅ C=O ⇌ O−C−O−H, pričom "⋅" znázorňuje miesto, kde sa v procese vytvorí nová väzba.

Valenčná tautoméria
Valenčná tautoméria je druhu tautomérie, pri ktorej sa rýchlo tvorí a zaníka obyčajna alebo dvojitá väzba, a to bez zmeny polohy atómov alebo skupín.[9] Je odlišná od prorotropickej tautomérie a spočíva v rýchlej reorganizácii elektrónov tvoriacich väzby.

Párom valenčných tautomérov so vzorcom C6H6O sú oxepin a benzénoxid.[9][10]
Iné príklady tohto typu tautomérie je možné vidieť napríklad u bullvalénu a u otvorených či cyklických foriem niektorých heterocyklov, ako sú azidy a tetrazoly.[11]
Valenčné tautoméry vyžadujú zmenu v molekulárnej geometrii a nemali by sa zamienať s rezonančnými štruktúrami.
Referencie
- Antonov L. Tautomerism: Methods and Theories. 1st. vyd. Weinheim, Germany : Wiley-VCH, 2013. ISBN 978-3-527-33294-6.
- Antonov L. Tautomerism: Concepts and Applications in Science and Technology. 1st. vyd. Weinheim, Germany : Wiley-VCH, 2016. ISBN 978-3-527-33995-2.
- Advanced Organic Chemistry. 5th. vyd. New York : Wiley Interscience, 2001. ISBN 978-0-471-58589-3. S. 1218–1223.
- The Tautomerism of heterocycles. New York : Academic Press, 1976. Dostupné online. ISBN 978-0-12-020651-3.
- Smith, Kyle T.; Young, Sherri C.; DeBlasio, James W.; Hamann, Christian S. (27 January 2016). "Measuring Structural and Electronic Effects on Keto–Enol Equilibrium in 1,3-Dicarbonyl Compounds". Journal of Chemical Education. 93 (4): 790–794. doi:10.1021/acs.jchemed.5b00170.
- Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Tautomerism". doi:10.1351/goldbook.T06252
- Roman M. Balabin. Tautomeric equilibrium and hydrogen shifts in tetrazole and triazoles: Focal-point analysis and ab initio limit. J. Chem. Phys., 2009, s. 154307. DOI: 10.1063/1.3249968. PMID 20568864.
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "valence tautomerism". doi:10.1351/goldbook.V06591
- E. Vogel and H. Günther. Benzene Oxide-Oxepin Valence Tautomerism. Angewandte Chemie International Edition in English, 1967, s. 385–401. DOI: 10.1002/anie.196703851.
- Lakshman Mahesh K., Singh Manish K., Parrish Damon, Balachandran Raghavan, Day Billy W.. Azide−Tetrazole Equilibrium of C-6 Azidopurine Nucleosides and Their Ligation Reactions with Alkynes. The Journal of Organic Chemistry, 2010, s. 2461–2473. DOI: 10.1021/jo902342z. PMID 20297785.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Tautomer na anglickej Wikipédii.
| Chemický portál |