Oxid dusnatý
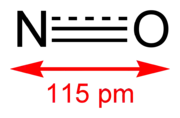
Oxid dusnatý je anorganická chemická zlúčenina, jeden z oxidov dusíka. Skladá sa z jedného atómu dusíka a jedného atómu kyslíka, ktoré sú spojené dvojitou väzbou.
| oxid dusnatý | |||||||
 oxid dusnatý | |||||||
 oxid dusnatý | |||||||
| Všeobecné vlastnosti | |||||||
| Sumárny vzorec | NO | ||||||
| Vzhľad | bezfarebný plyn | ||||||
| Fyzikálne vlastnosti | |||||||
| Molekulová hmotnosť | 30,0 u | ||||||
| Molárna hmotnosť | 30,006 1 g/mol | ||||||
| Teplota topenia | -163,6 °C (109,6 K) | ||||||
| Teplota varu | -151,7 °C (121,4 K) | ||||||
| Kritický bod | -93 °C (180 K), 6 485 kPa | ||||||
| Hustota | 1,269 g/cm³ (-150 °C) 0,001 340 2 g/cm³ (0 °C) | ||||||
| Rozpustnosť | vo vode: 7,34 ml/100 g (0 °C) 2,37 ml/100 g (60 °C) v polárnych rozpúšťadlách: alkoholy v nepolárnych rozpúšťadlách: sírouhlík | ||||||
| Termochemické vlastnosti | |||||||
| Entropia topenia | 76,6 J/g | ||||||
| Štandardná zlučovacia entalpia | 90,29 kJ/mol 87,7 kJ/mol (kvapalný) | ||||||
| Štandardná entropia | 210,75 J/mol·K | ||||||
| |||||||
| Ďalšie informácie | |||||||
| Číslo CAS | 10102-43-9 | ||||||
| Číslo UN | 1660 | ||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||
Oxid dusnatý je radikál, je veľmi reaktívny. Na vzduchu sa zlučuje s kyslíkom za vzniku oxidu dusičitého.
Produkcia NO
V malej miere sa NO uvoľňuje prirodzene z rastlín, ale vypúšťajú ho do vzduchu hlavne výfuky automobilov a komíny tepelných elektrární. Po reakcii s kyslíkom tvorí oxid dusičitý a s kombináciou s vodou kyselinu dusičnú. Takto NO prispieva k tvorbe kyslých dažďov. Čiastočne tiež poškodzuje ozón.
Priemyselne sa vyrába oxidáciou amoniaku:
- 4 NH3 + 5 O2 → 4 NO + 6 H2O.
Je medziproduktom pri výrobe kyseliny dusičnej.
Chemické vlastnosti
Mierne rozpustný vo vode, ale nereaguje s ňou. Silné oxidačné činidlo. Reaguje s kovmi, aj s mnohými organickými látkami. S kyslíkom reaguje na oxid dusičitý:
- 2 NO + O2 → 2 NO2
S halogénmi reaguje na nitrosyly:
- NCl3 + 2 NO → ClNO + N2O + Cl2,
- XeF2 + 2 NO → 2 FNO + Xe.
Reakciou s hydroxidmi alkalických kovov vzniká oxid dusný a dusík:
- 2 MOH + 4 NO → 2 MNO2 + N2O + H2O,
- 4 MOH + 6 NO → 4 MNO2 + N2 + 2 H2O.
NO v rastlinách
NO v rastlinách je signálnou látkou. Produkuje sa pomocou nitric oxid- syntázy (NOS), ktorá sa však odlišuje od enzýmu s podobnou funkciou známeho u živočíchov. Okrem toho ho produkuje nitrát reduktáza a to jednak cytoplazmatická a jednak membránovo viazaná (druhá za pomoci nitrit NO reduktázy). Produkcia NO pomocou nitrát reduktáz podlieha zmenám počas dňa, pričom cytoplazmatická je aktívnejšia cez deň, a membránovo viazaná v noci. Význam týchto rytmov nie je známy. NO v rastlinách pôsobí hlavne proti oxidačnému stresu.
Použitie
NO sa požíva v medicíne, ale má výrazné vedľajšie účinky.
