Fosfid
Fosfid je zlúčenina fosforu s nejakým menej elektronegatívnym prvkom alebo prvkami. Dvojprvkové zlúčeniny tvoria fosfor s väčšinou prvkov s výnimkou ortute, olova, antimónu, bizmutu, telúru a polónia.[1] Pomer prvkov vo fosfidoch môže byť pomerne variabilný, napríklad draslík tvorí deväť fosfidov: K3P, K4P3, K5P4, KP, K4P6, K3P7, K3P11, KP10.3, KP15), nikel ich má osem (Ni3P, Ni5P2, Ni12P5, NiP2, Ni5P4, NiP, NiP2, NiP3).[1] Väčšina z nich je dobre rozpustná v tukoch.
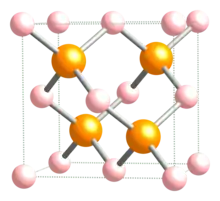
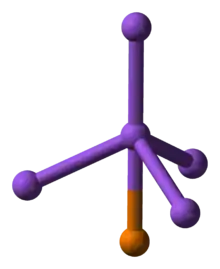
Triedenie
Triedenie fosfidov je komplikované.[2] Na základe štruktúry a reaktivity môžu byť fosfidy klasifikované do týchto skupín:[1]
- fosfidy iónové, obsahujúce anióny P3-. Tvoria ich alkalické kovy (M3P, napr. Na3P) a kovy alkalických zemín (M3P2, napr. Ca3P2)
- polyfosfidy obsahujúce napr. ión P24-, ión P113-; polymérové reťazcovité ióny (napr. skrutkovicovitý P-)n a niektoré trojrozmerné zložité štruktúry)
- fosfidy s jedným atómom fosforu, polovodiče (napr. GaP) až vodiče (TaP[3])
Polyfosfidové ióny P34- (vyskytujúce sa v K4P3) a P45- (vyskytujúce sa v K5P4) sú radikálové anióny s nepárnym počtom valenčných elektrónov, čo z nich robí paramagnetické látky.[1]
Výskyt v prírode
Schreibersit - vzorec (Fe,Ni)3P, je bežne prítomný v niektorých druhoch meteoritov.[4][5]
Referencie
- H.G. Von Schnering; W. Hönle. Encyclopedia of Inorganic Chemistry. New Jersey : John wiley & Sons, 1994. ISBN 0-471-93620-0. Kapitola Phosphides - Solid state chemistry. (po anglicky)
- Norman Neil Greenwood, Alan Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997. ISBN 0-7506-3365-4
- C. S. Blackman, C. J. Carmalt, S. A. O'Neill, I. P. Parkin, K. C. Molloy, L. Apostolico. Chemical vapour deposition of group Vb metal phosphide thin films. J. Mater. Chem., 2003, 13. DOI:10.1039/b304084b
- Mindat
- Handbook of Mineralogy
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Fosfid na českej Wikipédii.
| Chemický portál |