Chlórbenzén
Chlórbenzén je bezfarebná horľavá aromatická organická zlúčenina. Najčastejšie sa používa ako rozpúšťadlo a prekurzor na výrobu mnohých chemikálií.[2]
| Chlórbenzén | |||||||||||||||||||||||||
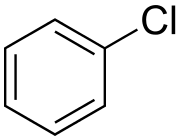 Chlórbenzén | |||||||||||||||||||||||||
 Chlórbenzén | |||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||
| Sumárny vzorec | C6H5Cl | ||||||||||||||||||||||||
| Synonymá | monochlórbenzén, fenylchlorid, benzénchlorid | ||||||||||||||||||||||||
| Vzhľad | bezfarebná kvapalina so zápachom pripomínajúcim mandle[1] | ||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||
| Molárna hmotnosť | 112,56 g/mol | ||||||||||||||||||||||||
| Teplota topenia | −45 °C | ||||||||||||||||||||||||
| Teplota varu | 131 °C | ||||||||||||||||||||||||
| Hustota | 1,11 g·cm-3 | ||||||||||||||||||||||||
| Rozpustnosť | miešateľný s väčšinou organických rozpúšťadiel | ||||||||||||||||||||||||
| Teplota vzplanutia | 29 °C | ||||||||||||||||||||||||
| Medze výbušnosti | 1,3 - 9,6 %[1] | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||
Využitie
Chlórbenzén sa využíva najmä pri výrobe herbicídov, farbív a gumy. Kvôli svojej vysokej teplote varu sa využíva ako rozpúšťadlo pri mnohých laboratórnych aj priemyselných procesoch.
Priemyselne sa taktiež vo veľkých množstvách nitruje na 2-chlórnitrobenzén a 4-chlórnitrobenzén, ktoré sa oddeľujú. Z nitrochlórbenzénu sa dá ďalej pripraviť nitrofenol pomocou hydroxidu sodného, nitroanizol pomocou metoxidu sodného a nitroanilín pomocou amoniaku.
V minulosti sa častokrát používal aj pri výrobe rôznych pesticídov, najmä DDT. To sa pripravuje reakciou chlórbenzénu s trichlóracetaldehydom.
Okrem toho bol v minulosti využívaný ako hlavný zdroj fenolu, ktorý sa z neho pripravoval reakciou s taveninou hydroxidu sodného. Reakcia prebiehala pri 350 °C a ako vedľajší produkt vznikal chlorid sodný:
C6H5Cl + NaOH → C6H5OH + NaCl
Príprava
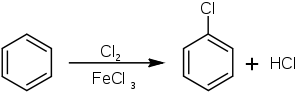
Príprava chlórbenzénu bola prvý krát popísaná v roku 1851. Pripravuje sa chloráciou benzénu, aby sa však predišlo naviazaniu viacerých atómov chlóru, treba použiť vhodný katalyzátor, v tomto prípade ide o Lewisovu kyselinu, ako napríklad chlorid železitý alebo chlorid sírnatý.[2] Ako vedľajší produkt pri tejto reakcii vzniká chlorovodík.
Referencie
- Chlorobenzene NIOSH (po anglicky)
- Chlorinated Benzenes and Other Nucleus‐Chlorinated Aromatic Hydrocarbons Ullmann's Encyclopedia of Industrial Chemistry (po anglicky)

