Ugiova reakce
Ugiova reakce je vícesložková organická reakce, při které reagují aldehyd nebo keton, amin, isokyanid a karboxylová kyselina za vzniku α-amidoamid.[1][2][3][4]
Reakce je pojmenována po Ivarovi Karlu Ugim, který ji v roce 1959 objevil.
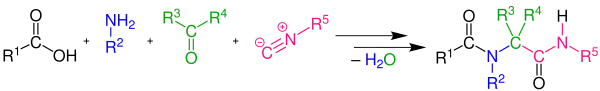
Reakce je exotermní a často je dokončená již několik minut po přidání isokyanidu. Nejvyšší výtežnosti se dosahuje při vysoké počásteční koncentraci (0,5 až 2,0 mol·dm−3) reaktantů. Reakce dobře probíhá při použití aprotických polárních rozpouštědel, jako je dimethylformamid, úspěšně však byly použity také ethanol a methanol. I při nekatalyzované reakci je výtěžnost obecně vysoká.[5][6][7][8][9][10][11]
Vzhledem k tomu, že produkty Ugiových reakcí mají potenciál ovlivňovat vlastnosti bílkovin, tak proběhlo několik pokusů o enantioselektivní Ugiovy reakce,[12] prvního úspěchu bylo dosaženo v roce 2018.[13]
Mechanismus
Pravděpodobný mechanismus Ugiovy reakce vypadá takto:[14]
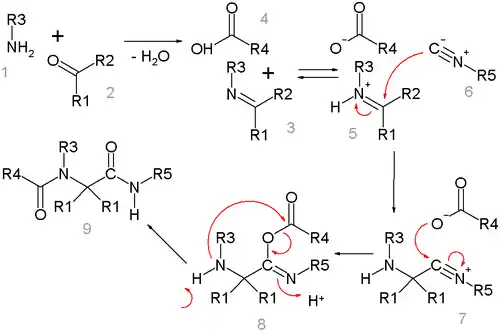
Amin 1 a keton 2 vzájemnou reakcí vytvoří za odštěpení molekuly vody imin 3. Jeho výměnou protonu s karboxylovou kyselinou 4 vzniká iminiový ion 5, na který se koncovým uhlíkem nukleofilně připojí isokyanid 6, čímž se vytvoří nitriliový ion 7. Na tento meziprodukt se nukleofilně naaduje anion karboxylové kyseliny za vzniku látky 8. Konečným krokem je Mummův přesmyk R4 acylové skupiny z kyslíku na dusík. Všechny kroky kromě závěrečného přesmyku jsou vratné.
V podobné Passeriniově reakci (při níž není přítomen amin) isokyanid reaguje přímo s karbonylovou sloučeninou, ostatní vlastnosti reakce jsou však stejné. Může probíhat souběžně s Ugiho reakcí a být tak zdrojem nečistot.
Varianty
Použití bifunkčních reaktantů výrazně rozšiřuje spektrum možných produktů reakce. Několik ze zkoumaných možností vedlo k zajímavým výsledkům. Byla vyzkoušena kombinace Ugiho reakce s vnitromolekulární Dielsovou–Alderovou reakcí.[15]
Další možností je Ugiova-Smilesova reakce, kdy je karboxylová kyselina nahrazena některým z fenolů. Při této reakci namísto Mummova přesmyku proběhne Smilesův přesmyk.[16]
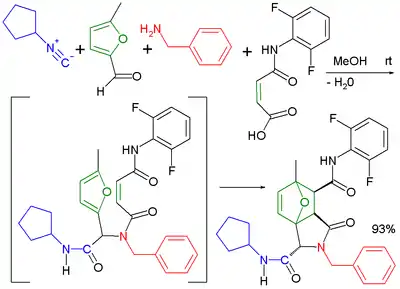 | 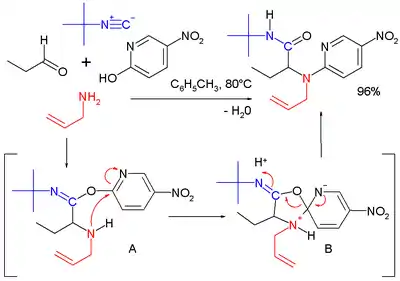 | |
| Ugiova–Dielsova–Alderova reakce | Ugiova–Smilesova reakce | |
Je také možná kombinace s Buchwaldovou–Hartwigovou reakcí.[17] Při Ugiově–Heckově reakci je druhým krokem Heckova reakce.
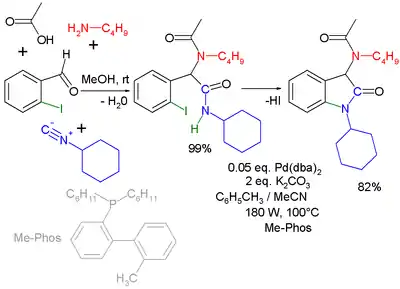 | 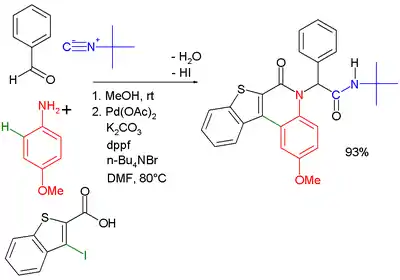 | |
| Ugiova–Buchwaldova–Hartwigova reaction[18] | Ugiova–Heckova reakce[19] | |
Kombinace aminu a karboxylové kyseliny
Byla popsána Ugiova reakce s použitím směsi aldehydů a karboxylových kyselin za vzniku různě velkých molekul laktamů[20] a také příprava γ-laktamů z ketokyselin.[21]
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Ugiova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Ugiova reakce na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Ugi reaction na anglické Wikipedii.
- Ivar Karl Ugi; R. Meyr; U. Fetzer; C. Steinbrückner. Versuche mit Isonitrilen. Angewandte Chemie. 1959, s. 386. DOI 10.1002/ange.19590711110.
- Ivar Karl Ugi; C. Steinbrückner. Über ein neues Kondensations-Prinzip. Angewandte Chemie. 1960, s. 267–268. DOI 10.1002/ange.19600720709.
- Ivar Karl Ugi. The α-Addition of Immonium Ions and Anions to Isonitriles Accompanied by Secondary Reactions. Angewandte Chemie International Edition in English. 1962, s. 8–21. DOI 10.1002/anie.196200081.
- Ugi Multicomponent Reaction André Boltjes, Haixia Liu, Haiping Liu, and Alexander Dömling Org. Synth. 2017, 94, 54 DOI:10.15227/orgsyn.094.0054
- Ugi, I., Lohberger S., Karl R. The Passerini and Ugi Reactions, Chapter 4.6, Comprehensive Organic Synthesis 1991, 2, 1083-1109. ISBN 0-08-040593-2, Pergamon, Oxford, 10196 pages (Review)
- Ivar Karl Ugi; B. Werner; A. Dömling. The Chemistry of Isocyanides, their MultiComponent Reactions and their Libraries. Molecules. 2003, s. 53–66. DOI 10.3390/80100053.
- L. Banfi and R. Riva (2005). The Passerini Reaction. Organic Reactions, Vol. 65 L. E. Overman Ed. Wiley. (ISBN 0-471-68260-8)
- P. A. Tempest. Recent advances in heterocycle generation using the efficient Ugi multiple-component condensation reaction. Current Opinion in Drug Discovery & Development. 2005, s. 776–788. DOI 10.3390/80100053.
- I. Ugi; S. Heck. The multicomponent reactions and their libraries for natural and preparative chemistry. Combinatorial Chemistry & High Throughput Screening. 2001, s. 1–34.
- H. Bienayme; C. Hulme; G. Oddon; P. Schmitt. Maximizing synthetic efficiency: Multi-component transformations lead the way. Chemistry: A European Journal. 2000, s. 3321–3329. DOI 10.1002/1521-3765(20000915)6:18<3321::AID-CHEM3321>3.0.CO;2-A.
- A. Dömling; I. Ugi. Multicomponent Reactions with Isocyanides. Angewandte Chemie International Edition in English. 2000, s. 3168–3210. DOI 10.1002/1521-3773(20000915)39:18<3168::AID-ANIE3168>3.0.CO;2-U.
- Qian Wang; De-Xian Wang; Mei-Xiang Wang; Jieping Zhu. Still Unconquered: Enantioselective Passerini and Ugi Multicomponent Reactions. Accounts of Chemical Research. 2018-04-30, s. 1290–1300. DOI 10.1021/acs.accounts.8b00105.
- Jian Zhang; Peiyuan Yu; Shao-Yu Li; He Sun; Shao-Hua Xiang; Jun Wang; Kendall N. Houk. Asymmetric phosphoric acid–catalyzed four-component Ugi reaction. Science. 2018-09-13, s. eaas8707. DOI 10.1126/science.aas8707.
- S. E. Denmark; Y. Fan. Catalytic, Enantioselective α-Additions of Isocyanides: Lewis Base Catalyzed Passerini-Type Reactions. Journal of Organic Chemistry. 2005, s. 9667–9676. DOI 10.1021/jo050549m. PMID 16292793.
- Complexity-Enhancing Acid-Promoted Rearrangement of Tricyclic Products of Tandem Ugi 4CC/Intramolecular Diels-Alder ReactionAlexei Ilyin, Volodymyr Kysil, Mikhail Krasavin, Irina Kurashvili, and Alexandre V. Ivachtchenko The Journal of Organic Chemistry; 2006; 71(25) pp 9544 - 9547; (Note) DOI:10.1021/jo061825f
- Direct Access to Heterocyclic Scaffolds by New Multicomponent Ugi-Smiles Couplings Laurent El Kaim, Marie Gizolme, Laurence Grimaud, and Julie Oble Organic Letters; 2006; 8(18) pp 4019 - 4021; (Letter) DOI:10.1021/ol061605o
- Rapid Access to Oxindoles by the Combined Use of an Ugi Four-Component Reaction and a Microwave-Assisted Intramolecular Buchwald-Hartwig Amidation Reaction Florence Bonnaterre, Michèle Bois-Choussy, and Jieping Zhu Organic Letters; 2006; 8(19) pp 4351–4354; (Letter) DOI:10.1021/ol061755z
- Druhou část představuje reakce Pd(dba)2 a fosfinového ligandu Me-Phos
- Heckova reakce probíhá za přítomnosti octanu palladnatého, dppf, uhličitanu draselného a tetra-n-butylamoniumbromidu v dimethylformamidu.
- J. Zhang; A. Jacobson; J. R. Rusche; W. Herlihy. Unique Structures Generated by Ugi 3CC Reactions Using Bifunctional Starting Materials Containing Aldehyde and Carboxylic Acid. The Journal of Organic Chemistry. 1999, s. 1074–1076. DOI 10.1021/jo982192a. PMID 11674195.
- K. M. Short; A. M. Mjalli. A solid-phase combinatorial method for the synthesis of novel 5- and 6-membered ring lactams. Tetrahedron Letters. 1997, s. 359–362. DOI 10.1016/S0040-4039(96)02303-9.
- K. Rossen; Pye; L. M. DiMichele; R. P. Volante; P. J. Reider. An efficient asymmetric hydrogenation approach to the synthesis of the Crixivan piperazine intermediate. Tetrahedron Letters. 1998, s. 6823–6826. DOI 10.1016/S0040-4039(98)01484-1.