Trimethylboran
Trimethylboran (zkráceně TMB) je organická sloučenina se vzorcem B(CH3)3, na vzduchu samozápalná.
| Trimethylboran | |
|---|---|
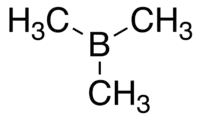
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | trimethylboran |
| Ostatní názvy | trimethylbor, TMB |
| Funkční vzorec | (CH3)3B |
| Sumární vzorec | C3H9B |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 593-90-8 |
| EC-no (EINECS/ELINCS/NLP) | 209-816-3 |
| PubChem | 68979 |
| SMILES | CB(C)C |
| InChI | 1S/C3H9B/c1-4(2)3/h1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 55,91 g/mol |
| Teplota tání | −161,5 °C (111,6 K)[1] |
| Teplota varu | −20,2 °C (253,0 K)[1] |
| Hustota | 0,625 g/cm3[1] (−100 °C) |
| Rozpustnost ve vodě | reaguje |
| Bezpečnost | |
| [1] | |
| H-věty | H220 H250 H280 H314[1] |
| P-věty | P210 P222 P260 P264 P280 P301+330+331 P302+334 P303+361+353 P304+340 P305+351+338 P310 P321 P363 P370+378 P377 P381 P403 P405 P422 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Vlastnosti
Jako kapalina je tato látka bezbarvá. Nejsilnější pásy v infračerveném spektru má při 1330 cm−1, 3010 cm−1 a 1185 cm−1.
Její teplota tání činí −161,5 °C a teplota varu je −20,2 °C.
Tlak páry lze udávat pomocí vzorce log P = 6,1385 + 1,75 log T − 1393,3/T − 0,007735 T, kde T je teplota v kelvinech.[2] Měrné skupenské teplo varu má hodnotu 25,6 kJ/mol.[3]
Příprava
Trimethylboran popsal Edward Frankland v roce 1862,[4] také získal jeho adukt s amoniakem.[5]
Vzhledem ke své nebezpečnosti nebyla tato sloučenina významněji zkoumána do roku 1921, kdy Alfred Stock a Friedrich Zeidler použili na její přípravu reakci plynného chloridu boritého s dimethylzinkem.[6]
Trimethylboran může být také připraven z Grignardových činidel, pak ovšem obsahuje nečistoty vzniklé z rozpouštědla. V malém množství může být, s 98% výtěžností, vytvořen reakcí trimethylhliníku s bromidem boritým ve směsi dibutyletheru a hexanu.[2]
K dalším možným postupům patří reakce tributylborátu s chloridem trimethylhlinitým a tetrafluorboritanu draselného s trimethylhliníkem.[7]
Je také možné použít reakci fluoridu boritého s methylmagnesiumjodidem.[8]
Reakce
Trimethylboran je na vzduchu ve vyšších koncentracích samozápalný, hoří zeleným plamenem.[9]
Pomalou oxidací kyslíkem v roztoku nebo plynné fázi lze získat dimethyltrioxadiboralan, obsahující cyklus se dvěma atomy boru a třemi aomy kyslíku; hlavním produktem je však dimethylborylmethylperoxid, jenž se rychle rozkládá na dimethoxymethylboran.[10]
Trimethylboran je silnou Lewisova kyselina, vytváří adukty s amoniakem: (NH3):B(CH3)3.[11] i jinými Lewisovými zásadami. Lewisovská kyselost B(CH3)3 byla analyzována pomocí ECW modelu, kde se zjistilyhodnoty EA = 2,90 a CA = 3,60. Při vzniku aduktu s trimethylaminem se objevuje sterické odpuzování atomů N methylových skupin na B. ECW modelem lze určit sílu těchto sterických efektů.
Trimethylboran za pokojové teploty reaguje s vodou a chlorem. Také může reagovat s mastnotou, ovšem nikoliv s polytetrafluorethylenem nebo sklem.[2]
Trimethylboran rovněž vstupuje do reakce s diboranem, kde dochází k disproporcionaci na methyldiboran a dimethyldiboran, (CH3)BH2.BH3 a (CH3)2BH.BH3.
V plynném skupenství reaguje s trimethylfosfinem za vzniku pevné soli, přičemž reakční teplo je −170 kJ/mol. Tento adukt má skupenské teplo sublimace −103 kJ/mol.
S trimethylarsinem a trimethylstibinem TMB nereaguje.[8]
Methyllithium s trimethylboranem vytváří tetramethylboritanovou sůl se vzorcem LiB(CH3)4. Tetramethylboritanový anion je izoelektronický s neopentanem, tetramethylsilanem a tetramethylamonným kationtem.
Použití
Trimethylboran se používá k počítání neutronů, kde musí být velmi čistý.[11]
Také se využívá při chemických depozicích z plynné fáze v případech, kde je třeba bor a uhlík deponovat společně.
Reference
V tomto článku byl použit překlad textu z článku Trimethylborane na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/68979
- William S. Rees. Trimethylborane. Inorganic Syntheses. 1990, s. 339.
- Trimethylborane
- E. Frankland. Ueber eine neue Reihe organischer Verbindungen, welche Bor enthalten. Justus Liebigs Annalen der Chemie. 1862, s. 129–157. DOI 10.1002/jlac.18621240102.
- R. Nishiyabu; Y. Kubo; T. D. James; J. S. Fossey. Boronic acid building blocks: tools for self assembly. Chemical Communications. 2011, s. 1124–1150. DOI 10.1039/C0CC02921A. PMID 21113558.
- A. Stock; F. Zeidler. Zur Kenntnis des Bormethyls und Boräthyls. Berichte der Deutschen Chemischen Gesellschaft A/B. 1921, s. 531–541. Dostupné online. DOI 10.1002/cber.19210540321.
- Roland Köster; Paul Binger; Wilhelm V. Dahlhoff. A Convenient Preparation of Trimethylborane and Triethylborane. Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry. 1973, s. 359–367. DOI 10.1080/00945717308057281.
- Donald Charles Mente. The Reactions of Trimethyl group Va Lewis Bases with simple Boron Lewis Acids [online]. 1975 [cit. 2021-11-10]. Dostupné v archivu pořízeném dne 2011-08-15.
- Herbert Ellern. Military and Civilian Pyrotechnics. [s.l.]: Chemical Publishing Company, 1968. Dostupné online. ISBN 9780820603643.
- Lawrence Barton; John M. Crump; Jeffrey B. Wheatley. Trioxadiborolanes from the oxidation of methyldiborane. Journal of Organometallic Chemistry. 1974, s. C1–C3. DOI 10.1016/s0022-328x(00)82027-6.
- Gaylon S. Ross et al. Preparation of High Purity Trimethylborane. Journal of Research of the National Bureau of Standards Section A. 1961-10-02. Dostupné v archivu pořízeném dne 2011-10-19.


