Thiosulfináty
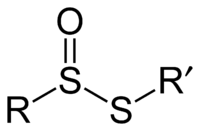
Thiosulfináty jsou organické sloučeniny obsahující thiosulfinátovou skupinu R-S(O)-S-R' (R a R' jsou organické substituenty). Jedná se o estery alkanthiosulfinových nebo arenthiosulfinových kyselin. Patří mezi sloučeniny se zoxidovanou disulfidovou vazbou, společně s thiosulfonáty (R-SO2-S-R'), α-disulfoxidy (R-S(O)-S(O)-R), sulfinylsulfony (R-S(O)-SO2-R') a α-disulfony (R-SO2-SO2-R'). Thiosulfinátová skupina může být acyklická i cyklická.[1][2]
Výskyt
V rostlinách se vyskytuje řada cyklických i acyklických thiosulfinátů, příkladem je alicin (CH2=CHCH2S(O)SCH2CH=CH2), který se uvolňuje při drcení česneku. Alicin objevil v roce 1944 Chester John Cavallito. Drcením částí různých rostlin rodu česnek (Allium) a brukev (Brassica) se uvolňují methyl-, n-propyl-, 1-propenyl-, 2-propenyl-, n-butyl-, 1-butenyl- i 2-butenylthiosulfináty.[4][5] Kořeny rostliny Petiveria alliacea obsahují S-(2-hydroxyethyl)2-hydroxyethan)thiosulfinát, S-(2-hydroxylethyl)fenylmethanthiosulfinát, S-benzyl-2-hydroxyethan)thiosulfinát a S-benzyl-fenylmethanthiosulfinát.[6] V tropické rostlině Sphenoclea zeylanica byly nalezeny zeylanoxidy, cyklické thiosulfináty odvozené od 1,2-dithiolan-1-oxidu. Tyto sloučeniny mají chirální centra na atomech uhlíku i síry.[7] S-oxid kyseliny asparagusinové,[8] nalezený v chřestu lékařském a brugierol,[9] vyskytující se v rostlině Brugiera conjugata, také patří mezi thiosulfináty.
Vznik a reakce
Prvním, kdo popsal přípravu thiosulfonátů, byl v roce 1947 Chester John Cavallito; šlo o oxidaci příslušných disulfidů.[10] Příkladem poměrně stabilního thiosulfinátu je terc-butylthiosulfinát ((CH3)3CS(O)SC(CH3)3), který lze připravit v opticky čisté formě asymetrickou oxidací di-terc-butyldisulfidu peroxidem vodíku.[11] Zahříváním se rozkládá na kyselinu terc-butanthiosulfoxylovou.[12] Podobným způsobem se dá získat racemický methylmethanthiosulfinát (CH3S(O)SCH3) z dimethyldisulfidu oxidací kyselinou peroxooctovou.[13] Methylmethanthiosulfinát se teplem rozkláda za vzniku kyseliny methansulfenové (CH3SOH), nejjednodušší sulfenové kyseliny, a thioformaldehydu (CH2=S). Rovněž se může disproporcionovat na dimethyldisulfid a methylmethanthiosulfonát (CH3SO2SCH3) či v Pummererově přesmyku přeměnit na CH3S(O)CH2SSCH3.[14][15] Dithiiran 1-oxid, sulfinát s tříčlenným cyklem, lze připravit přesmykem z 1,3-dithietanu.[16] Podobný 3-(9-triptycyl)dithiiran-1-oxid byl připraven reakcí (9-triptycyl)diazomethanu s S8O. Pomocí rentgenové krystalografie bylo zjištěno, že molekula tohoto dithiiran-1-oxidu má velmi dlouhou vazbu síra-síra (211,9(3) pm).[17]
Thiosulfináty jsou meziprodukty při oxidaci thiolů na sulfonové kyseliny.
Vlastnosti
Allicin, S-benzylfenylmethanthiosulfinát, má společně s dalšími podobnými látkami díky schopnosti tvorby sulfenových kyselin antioxidační účinky.[18] Acyklické sulfináty z rostlin rodů česnek a brukev působí protibakteriálně, proti parazitům a inhibují aktivitu cysteinproteázy, zatímco přírodní 1,2-dithiolan-1-oxidy jsou inhibitory růstu. Thiosulfináty v rostlinách patřících do rodu Petiveria mají podobné vlastnosti.[19] Thiosulfináty mají centrum tvořené propojením čtyřmocné a dvoumocné síry, přičemž čtyřmocná síra je stereogenní. Přeměna disulfidu na thiosulfinát vede k oslabení vazby S-S, u molekuly (C6H5)S(O)S(C6H5) se energie vazby sníží z 16,7 na 8,25 kJ.mol−1,[20] v důsledku čehož jsou thiosulfináty obvykle nestabilní a poměrně reaktivní. Z těchto důvodů se směsi rostlinných sulfinátů snadněji analyzují pomocí vysokoúčinné kapalinové chromatografie (HPLC) než plynovou chromatografií, kterou ovšem lze použít u některých thiosulfinátů s nižšími molekulovými hmotnostmi. Od sulfoxidů lze thiosulfináty odlišit infračervenou spektroskopií, jelikož mají absorpční pás odpovídající vazbě vazby S=O okolo 1078 cm−1, zatímco u sulfoxidů se nachází na 1030–1060 cm−1.[21]
Reference
V tomto článku byl použit překlad textu z článku Thiosulfinate na anglické Wikipedii.
- J. L. Kice. Mechanisms and reactivity in reactions of organic oxyacids of sulfur and their anhydrides. Advances in Physical Organic Chemistry. 1980, s. 65–181. DOI 10.1016/S0065-3160(08)60128-8.
- T. Takata; T. Endo. Thiosulphinic acids and esters. The Chemistry of Sulphinic Acids, Esters and Their Derivatives, S. Patai, Ed.. 1990, s. 527–575. DOI 10.1002/9780470772270.ch18.
- S. Braverman; M. Cherkinsky; S. Levinger. Alkanethiosulfinic Acid Esters. Sci. Synth.. 2007, s. 229–235. DOI 10.1002/9780470772270.ch18.
- R. Kubec; R. B. Endo; A. J. Dane; R. A. Musah; J. Schraml; A. Vattekkatte; E. Block. Applications of DART Mass Spectrometry in Allium Chemistry. (Z)-Butanethial S-Oxide and 1-Butenyl Thiosulfinates and their S-(E)-1-Butenylcysteine S-Oxide Precursor from Allium siculum. Journal of Agricultural and Food Chemistry. 2010, s. 1121–1128. DOI 10.1021/jf903733e. PMID 20047275.
- E. Block; A. J. Dane; S. Thomas; R. B. Cody. Applications of Direct Analysis in Real Time–Mass Spectrometry (DART-MS) in Allium Chemistry. 2-Propenesulfenic and 2-Propenesulfinic Acids, Diallyl Trisulfane S-Oxide and Other Reactive Sulfur Compounds from Crushed Garlic and Other Alliums. Journal of Agricultural and Food Chemistry. 2010, s. 4617–4625. DOI 10.1021/jf1000106. PMID 20225897.
- R. Kubec; S. Kim; R. A. Musah. S-Substituted cysteine derivatives and thiosulfinate formation in Petiveria alliacea--Part II. Phytochemistry. 2002, s. 675–680. Dostupné v archivu pořízeném dne 2016-03-03. DOI 10.1016/S0031-9422(02)00328-X. Archivováno 3. 3. 2016 na Wayback Machine
- Allelochemicals of the tropical weed Sphenoclea zeylanica. Phytochemistry. 2000, s. 131–140. DOI 10.1016/S0031-9422(00)00264-8.
- H. Yanagawa; T. Kato; Y. Kitahara. Asparagusic acid-S-oxides, new plant growth regulators in etiolated young asparagus shoots. Tetrahedron Letters. 1973, s. 1073–1075. DOI 10.1016/S0040-4039(01)95907-6.
- T. Kato; M. Numata. Brugierol and isobrugierol, trans- and cis-1,2-dithiolane-1-oxide, from Brugiera conjugata. Tetrahedron Letters. 1972, s. 203–206. DOI 10.1016/S0040-4039(01)84280-5.
- L. D. Small; J. H. Bailey; C. J. Cavallito. Alkyl thiolsulfinates. Journal of the American Chemical Society. 1947, s. 1710–1713. DOI 10.1021/ja01199a040.
- D. J. Weix; J. A. Ellman. (RS)-(+)-2-Methyl-2-Propanesulfinamide [tert-Butanesulfinamide]. Organic Syntheses. 2005, s. 157. DOI 10.1021/ja01199a040.
- E. Block. The Chemistry of Alkyl Thiosulfinate Esters. III. tert-Butanethiosulfoxylic Acid. Journal of the American Chemical Society. 1972, s. 644–645. DOI 10.1021/ja00757a060.
- T. L. Moore; D. E. O'Connor. The Reaction of Methanesulfenyl Chloride with Alkoxides and Alcohols. Preparation of Aliphatic Sulfenate and Sulfinate Esters. The Journal of Organic Chemistry. 1966, s. 3587–3592. DOI 10.1021/jo01349a027.
- E. Block; J. O'Connor. The Chemistry of Alkyl Thiosulfinate Esters. VI. Preparation and Spectral Studies. Journal of the American Chemical Society. 1974, s. 3921–3929. DOI 10.1021/ja00819a033.
- E. Block; J. O'Connor. The Chemistry of Alkyl Thiosulfinate Esters. VII. Mechanistic Studies and Synthetic Applications. Journal of the American Chemical Society. 1974, s. 3929–3944. DOI 10.1021/ja00819a034.
- A. Ishii; T. Akazawa; M. X. Ding; T. Honjo; J. Nakayama; M. Hoshino; M. Shiro. First isolable dithiiranes: 3-(1,1,3,3-tetramethyl-4-oxo-4-phenylbutyl)-3-phenyldithiirane 1-oxides. Journal of the American Chemical Society. 1993, s. 4914–4915. DOI 10.1021/ja00064a072.
- A. Ishii; T. Kawai; M. Noji; J. Nakayama. Synthesis and reactions of a monosubstituted dithiirane 1-oxide, 3-(9-triptycyl)dithiirane 1-oxide. Tetrahedron. 2005, s. 6693–6699. DOI 10.1016/j.tet.2005.05.017.
- P. T. Lynett; K. Butts; V. Vaidya; G. E. Garretta; D. A. Pratt. The mechanism of radical-trapping antioxidant activity of plant-derived thiosulfinates. Organic and Biomolecular Chemistry. 2011, s. 3320–3330. DOI 10.1039/c1ob05192j.
- S. Kim; R. Kubec; R. A. Musah. Antibacterial and antifungal activity of sulfur-containing compounds from Petiveria alliacea. Journal of Ethnopharmacology. 2006, s. 188–192. Dostupné v archivu pořízeném dne 2016-03-03. DOI 10.1016/j.jep.2005.08.072. PMID 16229980. Archivováno 3. 3. 2016 na Wayback Machine
- P. Koch; E. Ciuffarin; A. Fava. Thermal disproportionation of aryl arenethiolsulfinates. Kinetics and mechanism. Journal of the American Chemical Society. 1970, s. 5971–5977. DOI 10.1021/ja00723a026.
- E. Block. Garlic and Other Alliums: The Lore and the Science. [s.l.]: Royal Society of Chemistry, 2010. ISBN 0-85404-190-7. S. 4617–4625.