Tetrahydropyran
Tetrahydropyran (THP, systematický název oxan[2]) je organická sloučenina složená z nasyceného šestičlenného cyklu, který obsahuje jeden kyslíkový a pět uhlíkových atomů. Jeho název je odvozen od pyranu, z něhož lze THP získat přidáním čtyř vodíků. Je to bezbarvá těkavá kapalina. Častěji než se samotným tetrahydropyranem se lze setkat s jeho deriváty. Tetrahydropyranylové (THP-) ethery získávané reakcí alkoholů s dihydropyranem jsou běžnými meziprodukty organické syntézy. Tetrahydropyranový kruh (pět atomů uhlíku a kyslík) je základem pyranózových sacharidů, například glukózy.
| Tetrahydropyran | |
|---|---|
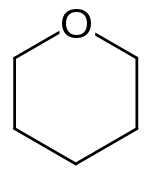
strukturní vzorec | |
model molekuly | |
| Obecné | |
| Systematický název | oxan |
| Ostatní názvy | oxacyklohexan, THP |
| Anglický název | tetrahydropyran |
| Německý název | Tetrahydropyran |
| Sumární vzorec | C5H10O |
| Vzhled | bezbarvá těkavá kapalina |
| Identifikace | |
| Registrační číslo CAS | 142-68-7 |
| SMILES | O1CCCCC1 |
| InChI | 1S/C5H10O/c1-2-4-6-5-3-1/h1-5H2 |
| Vlastnosti | |
| Molární hmotnost | 86,13 g/mol |
| Teplota tání | −45 °C (228 K) |
| Teplota varu | 88 °C (361 K) |
| Hustota | 0,880 g/cm3 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
THP se vyrábí hydrogenací (vlastně adicí vodíku) dihydropyranu (DHP) Raneyovým niklem.
Reakce
V organické syntéze se 2-tetrahydropyranylová skupina poutžívá jako chránicí skupina pro alkoholy. Reakcí alkoholu s dihydropyranem vzniká tetrahydropyranylether, který chrání alkohol před řadou reakcí. Alkohol lze posléze snadno odstranit kyselou hydrolýzou za vzniku 5-hydroxypentanalu.
Ochrana alkoholů
Nejčastější ochranné metody
- Reakce alkoholu s dihydropyranem a kyselinou para-toluensulfonovou v dichlormethanu za pokojové teploty[3][4]
- 2-hydroxytetrahydropyranyl, trifenylfosfin a diethylazodikarboxylát v THF
Nejčastější odstranění chránicí skupiny
- Roztok kyseliny octové (AcOH) v THF nebo ve vodě
- Pyridinium p-toluensulfonát v ethanolu
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Tetrahydropyran na anglické Wikipedii.
- Tetrahydropyran. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- New IUPAC Organic Nomenclature - Chemical Information BULLETIN [online]. Dostupné online. (anglicky)
- WUTS, Peter G. M.; GREENE, Theodora W. Greene's Protective Groups in Organic Synthesis, Fourth Edition - Wuts - Wiley Online Library. [s.l.]: [s.n.] Dostupné v archivu pořízeném dne 2020-01-25. DOI 10.1002/0470053488. (anglicky)
- ROBINSON, Anna; AGGARWAL, Varinder K. Asymmetric Total Synthesis of Solandelactone E: Stereocontrolled Synthesis of the 2-ene-1,4-diol Core through a Lithiation–Borylation–Allylation Sequence. Angewandte Chemie International Edition. 2010-09-03, s. 6673–6675. Dostupné online. ISSN 1521-3773. DOI 10.1002/anie.201003236. (anglicky)
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Tetrahydropyran na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tetrahydropyran na Wikimedia Commons

