Redoxní titrace
Redoxní titrace (také oxidačně-redukční titrace) je analytická volumetrická metoda, při níž se v reakci mezi odměrným roztokem a titrovanou látkou mění oxidační čísla.
Princip
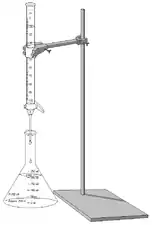
Do byrety se vkládá standardizovaný roztok, který reaguje s titrovanou látkou v baňce. Po zreagování všech molekul látky v baňce se významným způsobem změní redoxní potenciál roztoku. Bod ekvivalence lze také určit pomocí barevných změn, ke kterým může docházet po přidání indikátorů.
Různé redoxní titrace
Bichromatometrie
Tato metoda používá za titrační činidlo roztok dichromanu draselného, K2Cr2O7. Ten zde vystupuje jako oxidační činidlo. Výhoda této metody je, že dichroman draselný je tzv. primárním standardem. Velkou nevýhodou je vysoká toxicita dichromanu draselného (je zařazen mezi vysoce toxické látky), kvůli které se v současné době od bichromatometrie upouští.
Manganometrie
Titrace pomocí roztoku KMnO4, manganistanu draselného, je hojně používanou metodou stanovení široké škály oxidovatelných látek. Provádí se zpravidla v kyselém prostředí utvořeného pomocí kyseliny sírové, aby redukce manganistanu běžela kvantitativně na manganatou sůl. Pro určení bodu ekvivalence se dá použít potenciometrických metod, mnohem rychlejší je ale určení vizuální. Po zoxidování veškeré titrované látky první kapka přebytečného manganistanu zbarví roztok v baňce dorůžova.
Standardizace odměrného roztoku
Manganistan draselný není primárním standardem, tudíž je třeba jeho roztok standardizovat, abychom znali jeho přesnou koncentraci. Tato standardizace se provádí pomocí kyseliny šťavelové. Probíhá zde tato reakce:
- 2 KMnO4 + 5 HOOC-COOH + 3 H2SO4 → 2 MnSO4 + K2SO4 + 10 CO2 + 8 H2O
Reakce běží zpočátku velmi pomalu, proto je třeba směs v titrační baňce zahřát.
Titrace dusitanů
Dusitany jsou v kyselém prostředí nestálé. Proto se musí při stanovování dusitanů manganometricky postupovat obráceně: do byrety se dá roztok dusitanu, do titrační baňky okyselený manganistan. Titruje se do odbarvení roztoku.
Jodometrie
Tato titrační metoda je rovněž široce používaná. Její podstatou je téměř dokonale vratná redoxní reakce jodu na jodid a obráceně:
- 2 I− ←→ I2 + 2 e−
Při jodometrii se používá jako indikátor škrobový maz, který s jodem tvoří temně modrý komplex.
Přímá titrace
Při přímé titraci se do byrety dává standardizovaný roztok jodu (povětšinou v jodidu draselném), do titrační baňky se poté přidá trocha škrobu a titruje se do stálého tmavě modrého zabarvení. Takto prováděná jodometrie může vést k diskutabilním výsledkům, jelikož reakce s jodem může probíhat velmi pomalu.
Zpětná titrace
Metoda zpětné titrace pomůže eliminovat příliš pomalu běžící oxidaci jodem. Při tomto provedení se do titrační baňky dá přesné množství roztoku jodu tak, aby byl jod v nadbytku, baňka se poté nechá chvíli ve tmě, aby mohla proběhnout reakce s jodem. Nezreagovaný jod se poté titruje roztokem thiosíranu, který je jodem oxidován na tetrathionan:
- I2 + 2 S2O32− → S4O62− + 2 I−