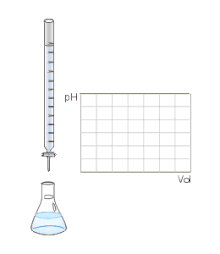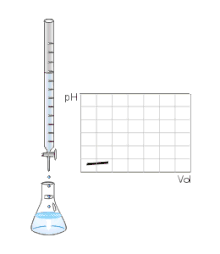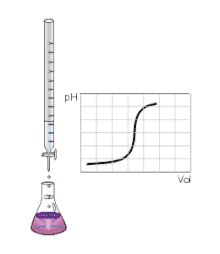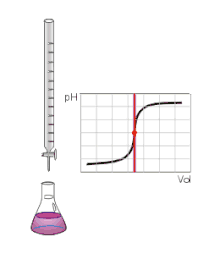
Bod ekvivalence
Bod ekvivalence (stechiometrický bod) se používá v analytické kvantitativní chemii a je to okamžik, kdy došlo k ukončení chemické reakce. Jde o dosažení stavu, kdy určovaná látka právě kvantitativně zreagovala s přidaným činidlem ve známém stechiometrickém poměru.
Určení bodu ekvivalence
Bod ekvivalence se určuje pomocí titrace, kdy se do určované látky postupně přidává titrační činidlo. Reakce mezi činidlem a určovanou látkou je znázorňována na titrační křivce. Bod ekvivalence na titrační křivce odpovídá bodu, kdy bylo k určované látce právě přidáno takové množství titračního činidla, které je stechiometricky ekvivalentní k určované látce.
Bod ekvivalence je určován pomocí indikátoru, který se přidává k určovanému roztoku. Jakmile dojde k přidání titračního činidla v ekvivalentním množství, indikátor zřetelně zareaguje s prvním přebytkem použitého titračního činidla.
Bod ekvivalence se pak projeví nápadnou změnou vlastností titrační směsi. Může to být změna barvy, pH, vodivosti, absorpce světla, teploty reakce nebo vznik sraženiny.
Metody k určení bodu ekvivalence
Neutralizační (acidobazické) metody
Pro neutralizační reakci je bodem ekvivalence okamžik, kdy se během titrace moly kyseliny a moly báze vzájemně zneutralizovaly a došlo ke změně pH roztoku. Jako indikátor se zde často používá fenolftalein, který mění barvu v závislosti na pH roztoku.
Elektrolytické metody
Při elektrolytických reakcích je bodem ekvivalence změna vodivost roztoku. Během titrace se vodivost roztoku mění v závislosti na iontech, které jsou v analyzovaném roztoku a reagují s přidávaným činidlem. Například během acidobazické titrace reagují ionty H3O + a OH − za vzniku neutrální H2O. To změní vodivost roztoku
Srážecí metody
Pro srážecí reakci je bodem ekvivalence okamžik, kdy během titrace vznikne pevná látka - sraženina. Klasickým příkladem je reakce mezi Ag + a Cl − za vzniku velmi nerozpustné soli AgCl.
Kalorimetrické metody
Pro endotermické nebo exotermické reakce je bodem ekvivalence okamžik, kdy se změní teplota reakce. Bod ekvivalence se stanovuje pomocí isotermálního titračního kalorimetru, který měří teplo vyrobené nebo spotřebované reakcí. Metoda se často využívá při biochemických titracích, například při analýze substrátů, které se váží na enzymy.
Spektroskopické metody
Pro spektroskopickou metodu je bodem ekvivalence okamžik, kdy dojde během reakce analyzovaného vzorku s titračním činidlem ke změně absorpce světla. Je založena na tom, že absorpce světla analyzovaného roztoku se mění při přidávání titračního činidla.
Externí odkazy
https://en.wikipedia.org/wiki/Equivalence_point
https://is.muni.cz/el/med/podzim2014/BVCP0121p/um/1-03_volumetrie__gravimetrie.pdf