Paterná vazba
Paterná vazba je neobvyklý druh chemické vazby, poprvé popsaný v roce 2005 u sloučeniny dichromu. Jednoduché, dvojné i trojné vazby se objevují běžně. Čtverné vazby jsou vzácnější, ale byly objeveny u sloučenin mnoha přechodných kovů, jako jsou chrom, molybden, wolfram a rhenium; ke konkrétním sloučeninám patří [Mo2Cl8]4− a [Re2Cl8]2−. Na paterných vazbách se podílí deset elektronů mezi dvěma atomy kovů v konfiguraci σ2π4δ4.
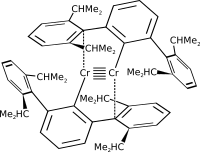
Některé vazby vyšších řádů mezi atomy kovů zprostředkovávají ligandy, které se vážou na kovové atomy a snižují vzdálenosti atomů, například dimer chromu může být stabilizován terfenylovými (2,6-bis(2,6-diisopropylfenyl)fenylovými) ligandy. Vzniklá sloučenina je stálá při teplotách do 200 °C.[1][2] Paterné vazby chrom-chrom byly zkoumány na základě teorie funkcionálu hustoty,[3] pomocí které byl také prozkoumán vliv terfenylového ligandu, v němž aryly interagují s atomy chromu velmi slabě a tím způsobují pouze malé zeslabení paterné vazby.[4] V roce 2007 bylo zjištěno, že pro RMMR sloučeniny s paternými vazbami existují dvě globální minima: trans molekulová geometrie a další trans geometrie se substituentem v pozici můstku.[5]
V roce 2007 byla vydána studie popisující nejkratší známou vazbu kov-kov (s délkou 180,28 pm) spočívající v paterné vazbě mezi atomy chromu s diazadienovými můstkovými ligandy.[6] Další známé komplexy obsahující paternou vazbu jsou komplex dichromu s [6-(2,4,6-triisopropylfenyl)pyridin-2-yl](2,4,6-trimethylfenyl)aminovými[7] či amidinátovými můstkovými ligandy.[8]
Sloučeniny s paternými vazbami se obvykle připravují redukcí sloučenin dimerních kovů pomocí grafitu draselného. Tím dojde k dodání valenčních elektronů do kovových center, což vytvoří dostatek elektronů na vznik paterné vazby.
 Příprava paterné vazby Cr–Cr
Příprava paterné vazby Cr–Cr
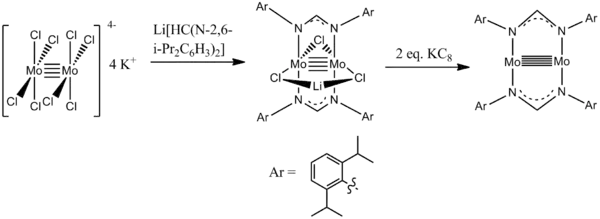
Dimolybdenové paterné vazby
V roce 2009 byl popsán komplex dimolybdenu a dvou diamidových ligandů obsahující paternou vazbu o délce 202 pm.[9] Látka byla připravena reakcí oktachlordimolybdenanu draselného (v jehož molekule je čtverná vazba Mo-Mo) s amidinátem lithným a následnou redukcí grafitem draselným.
Struktura vazby
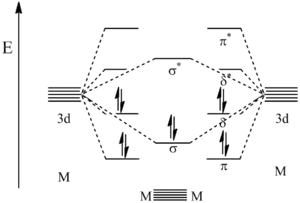
Paterné vazby mívají elektronovou konfiguraci σ2π4δ4 a skládají se tedy z jedné vazby sigma, dvou vazeb pí a dvou vazeb delta. Vazba sigma vzniká překryvem dz2 orbitalů kovových center. První vazba pí je výsledkem překryvu dyz orbitalů a druhá se tvoří překryvem dxz orbitalů. Delta vazby jsou tvořeny překrývajícími se dxy orbitaly a také kombinacemi dx2−y2 orbitalů.
Pomocí výpočtů na základě teorie molekulových orbitalů lze určit energie vazeb. Nejnižší energii mají π vazebné orbitaly, po nich následují σ vazebné orbitaly a následně δ vazebné orbitaly, které zde jsou HOMO. Protože deset valenčních elektronů účastnících se vazby vyplní prvních pět orbitalů, tak je další orbital (δ* protivazebný) zároveň LUMO. I když se π a δ orbitaly znázorňují jako degenerované, tak ve skutečnosti degenerované nejsou, protože tento model je zjednodušený a nezohledňuje hybridizaci orbitalů s, p a d, která mění jejich energetické hladiny.
Vliv ligandů na délku vazby
Délky paterných vazeb jsou významně ovlivňovány vlastnostmi ligandů navázaných na kovová centra. Téměř všechny komplexy s paternými vazbami mají bidentátní můstkové ligandy a i ty, které je nemají, například výše uvedený terfenylový komplex, mají určité vlastnosti můstkových ligandů. Bidentátní ligand může usnadňovat chelataci tím, že se atomy kovů k sobě přiblíží, čímž dojde ke zkrácení vazby. Zkrátit vazbu lze buď snížením vzdálenosti atomů v ligandu pozměněním jeho struktury, nebo vyvoláním sterických efektů, které změní konformaci ligandu.
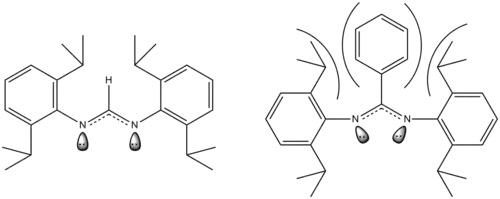 Vliv sterických efektů na bidentátní ligand
Vliv sterických efektů na bidentátní ligand
Na obrázku výše je zobrazen ligand dříve popsaného dimolybdenového komplexu. Pokud je na uhlíkový atom mezi dvěma dusíky navázán vodík, tak jsou sterické efekty slabé. Nahrazením tohoto vodíku rozměrnější fenylovou skupinou dojde ke změně poloh volných elektronových párů na atomech dusíku. Tyto volné páry vytvářejí vazby s kovovými centry a snížení vzdáleností mezi nimi tak také způsobí zmenšení vzdálenosti mezi kovovými atomy a tedy i délky paterné vazby. Například u uvedeného dimolybdenového komplexu se při záměně vodíku za fenylovou skupinu délka vazby zmenší z 201,87 pm na 201,57 pm. Podobné jevy byly pozorovány i u komplexů dichromu.[10]
Probíhají pokusy o přípravu kratších paterných vazeb.[11][12]
Reference
V tomto článku byl použit překlad textu z článku Quintuple bond na anglické Wikipedii.
- Steve Ritter. Quintuple Bond Makes Its Debut: First stable molecule with fivefold metal–metal bonding is synthesized. Chemical & Engineering News. 2005-07-26. Dostupné online.
- Tailuan Nguyen; Andrew D. Sutton; Marcin Brynda; James C. Fettinger; Gary J. Long; Philip Power. Synthesis of a Stable Compound with Fivefold Bonding Between Two Chromium(I) Centers. Science. 2005, s. 844–847. Dostupné online. DOI 10.1126/science.1116789. PMID 16179432. Bibcode 2005Sci...310..844N.
- Marcin Brynda; Laura Gagliardi; Per-Olof Widmark; Philip P. Power; Björn O. Roos. Quantum Chemical Study of the Quintuple Bond between Two Chromium Centers in [PhCrCrPh]: trans-Bent versus Linear Geometry. Angewandte Chemie International Edition. 2006, s. 3804–3807. Dostupné online. DOI 10.1002/anie.200600110. PMID 16671122.
- Giovanni La Macchia; Laura Gagliardi; Philip P. Power; Marcin Brynda. Large Differences in Secondary Metal−Arene Interactions in the Transition-Metal Dimers ArMMAr (Ar = Terphenyl; M = Cr, Fe, or Co): Implications for Cr−Cr Quintuple Bonding. Journal of the American Chemical Society. 2008, s. 5104–5114. Dostupné online. DOI 10.1021/ja0771890. PMID 18335988.
- Gabriel Merino; Kelling J. Donald; Jason S. D'Acchioli; Roald Hoffmann. The Many Ways To Have a Quintuple Bond. Journal of the American Chemical Society. 2007, s. 15295–15302. Dostupné online. DOI 10.1021/ja075454b. PMID 18004851.
- Kevin A. Kreisel; Glenn P. A. Yap; Olga Dmitrenko; Clark R. Landis; Klaus H. Theopold. The Shortest Metal–Metal Bond Yet: Molecular and Electronic Structure of a Dinuclear Chromium Diazadiene Complex. Journal of the American Chemical Society. 2007, s. 14162–14163. DOI 10.1021/ja076356t. PMID 17967028.
- Awal Noor; Frank R. Wagner; Rhett Kempe. Metal–Metal Distances at the Limit: A Coordination Compound with an Ultrashort Chromium–Chromium Bond. Angewandte Chemie International Edition. 2008, s. 7246–7249. Dostupné online. DOI 10.1002/anie.200801160. PMID 18698657.
- Yi-Chou Tsai; Chia-Wei Hsu; Jen-Shiang K. Yu; Gene-Hsiang Lee; Yu Wang; Ting-Shen Kuo. Remarkably Short Metal–Metal Bonds: A Lantern-Type Quintuply Bonded Dichromium(I) Complex. Angewandte Chemie International Edition. 2008, s. 7250–7253. Dostupné online. DOI 10.1002/anie.200801286. PMID 18683844.
- Yi-Chou Tsai; Hong-Zhang Chen; Chie-Chieh Chang; Jen-Shiang K. Yu; Gene-Hsiang Lee; Yu Wang; Ting-Shen Kuo. Journey from Mo–Mo Quadruple Bonds to Quintuple Bonds. Journal of the American Chemical Society. 2009, s. 12534–12535. Dostupné online. DOI 10.1021/ja905035f. PMID 19685872.
- Chai-Wei Hsu; Jen-Shiang K. Yu; Chun-Hsu Yen; Gene-Hsiang Lee; Yu Wang; Yi-Chou Tsa. Quintuply-Bonded Dichromium(I) Complexes Featuring Metal–Metal Bond Lengths of 1.74 Å. Angewandte Chemie International Edition. 2008, s. 9933–9936. Dostupné online. DOI 10.1002/anie.200803859. PMID 19016281.
- Awal Noor; Germund Glatz; Robert Muller; Martin Kaupp; Serhiy Demeshko; Rhett Kempe. Carboalumination of a chromium–chromium quintuple bond. Nature Chemistry. 2009, s. 322–325. DOI 10.1038/NCHEM.255. PMID 21500603. Bibcode 2009NatCh...1..322N.
- Chengbao Ni; Bobby D. Ellis; Gary J. Long; Philip P. Power. Reactions of Ar′CrCrAr′ with N2O or N3(1-Ad): complete cleavage of the Cr–Cr quintuple bond interaction. Chemical Communications. 2009, s. 2332–2334. DOI 10.1039/b901494b. PMID 19377676.