PEGylace
Jako PEGylace se označuje kovalentní i nekovalentní připojování polyethylenglykolu (PEG) na molekuly a makroskopické struktury, jako jsou léčiva nebo bílkoviny.[1][2][3] Provádí se zahříváním reaktivního derivátu PEG s příslušnou látkou. Kovalentní navázání polyethylenglykolu na léčivo může toto léčivo z pohledu imunitního systému zakrýt a také pomocí něj lze rozpustit hydrofobní léčiva a bílkoviny.[4]
_alternate.svg.png.webp)
Využití
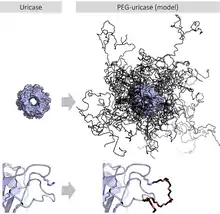
PEGylace spočívá v připojování řetězců PEG na molekuly, obvykle peptidy, bílkoviny a protilátky, za účelem vylepšení vlastností léčiv.[6] Při tom může například dojít ke změně chemické struktury, elektrostatického působení mezi molekulami či hydrofobnosti látky. Tímto dochází ke změně schopnosti látky navázat se na buněčné receptory a tím ovlivnění absorpce a distribuce. Rovněž lze pomocí PEGylace upravit rozpustnost léčiva a prodloužit intervaly mezi jeho dávkováním, čímž se často sníží toxicita, aniž by došlo k oslabení účinku, také zvýšit stabilitu a odolnost vůči proteázám.[7]
Ve výzkumu
Ve výzkumu se PEGylace uplatňuje při přenosu bílkovin, buněčné transfekci a úpravách genomu.[8]
Průběh
Prvník krokem PEGylace bývá funkcionalizace PEG na jednom z konců molekuly. Pokud k ní dojde na obou koncích, tak může být vzniklý produkt „homobifunkční“ (pokud se navážou dvě stejné skupiny) nebo „heterobifunkční“ (při navázání dvou různých skupin). Chemicky aktivní a nebo aktivované deriváty se připravují navázáním PEG na požadovanou molekulu.[9]
Výběr použité funkční skupiny se provádí podle druhu reaktivní skupiny na molekule, na kterou se má PEG navázat; u bílkovin to bývají reaktivní aminokyseliny jako například lysin, cystein, histidin, arginin, kyselina asparagová, kyselina glutamová, serin, threonin a tyrosin. Při konjugaci s aldehydovými polymery lze využít též aminovou skupinu na N-konci nebo karboxylovou skupinu na C-konci.[10]
Deriváty první generace se připravují reakcí PEG se skupinou, která má reaktivní hydroxyly, například anhydridem, acylchloridem nebo chlormravenčanem. U druhé generace se využívají reakce s vhodnějšími skupinami, jako jsou aldehydy, estery a amidy.
Objevuje se vysoká poptávka po heterobifunkčních derivátech polyethylenglykolu; lze je totiž použít ke spojení dvou molekul tam, kde je potřeba hydrofilní, flexibilní a biokompatibilní molekuly. Nejčastěji používanými funkčními skupinami u heterobifunkčních derivátů jsou maleimid, vinylsulfony, pyridyldisulfid, aminy, karboxylové kyseliny a estery N-hydroxysukcinimidu.
PEGylační činidla třetí generace se používají, pokud je polymer rozvětvený do tvaru připomínajícího hřeben nebo Y, kde snižují viskozitu a zlepšují akumulaci v orgánech.[11]
Omezení
Nepředvídatelná rychlost odstraňování derivátů PEG z krevní plazmy může vést k hromadění sloučenin s vysokou molekulovou hmotností v játrech, u něhož však není známo, že by bylo toxikologicky významné.[12] Změna délky řetězce může in vivo vést k nepředvídatelným změnám v odbourávání polymeru.[13] Stabilitu PEGylovaných produktů mohou také ovlivňovat reakční podmínky, jako jsou pH, teplota, doba provádění reakce a poměr látkového množství peptidu a derivátu PEG.[14] K překonání těchto omezení bylo vyvinuto několik postupů, například změna molekulové hmotnosti nebo polohy a druhu vazby PEG na peptid.[15]
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku PEGylation na anglické Wikipedii.
- J. V. Jokerst; T. Lobovkina; R. N. Zare; S. S. Gambhir. Nanoparticle PEGylation for imaging and therapy. Nanomedicine. 2011, s. 715–728. PMID 21718180.
- K. Knop; R. Hoogenboom; D. Fischer; U. S. Schubert. Poly(ethylene glycol) in Drug Delivery: Pros and Cons as Well as Potential Alternatives. Angewandte Chemie International Edition. 2010, s. 6288–6308. PMID 20648499.
- F. M. Veronese; A. Mero. The impact of PEGylation on biological therapies. BioDrugs. 2008, s. 315–329. PMID 18778113.
- V. B. Damodaran; C. J. Fee. Protein PEGylation: An overview of chemistry and process considerations. European Pharmaceutical Review. 2010, s. 18–26. Dostupné online.
- M. R. Sherman; M. G. Saifer; F. Perez-Ruiz. PEG-uricase in the management of treatment-resistant gout and hyperuricemia. Advanced Drug Delivery Reviews. 2008-03-01, s. 59–68. PMID 17826865.
- F. M. Veronese; J. M. Perez-Ruiz. Introduction and overview of peptide and protein pegylation. Advanced Drug Delivery Reviews. 2002, s. 453–456. PMID 12052707.
- P. Milla; F. Dosio. PEGylation of proteins and liposomes: a powerful and flexible strategy to improve the drug delivery. Current Drug Metabolism. 2012-01-13, s. 105–119. PMID 21892917.
- Daniel Balazs; W. T. Godbey. Liposomes for Use in Gene Delivery. Journal of Drug Delivery. 2010-10-29, s. 326497. PMID 21490748.
- G. Pasu; F. M. Veronese. State of the art in PEGylation: The great versatility achieved after forty years of research. Journal of Controlled Release. 2012, s. 461–472. PMID 22094104.
- Conan J. Fee; Vinod B. Damodaran. Production of PEGylated Proteins. Biopharmaceutical Production Technology. 2012, s. 199. ISBN 9783527653096.
- Sinéad M. Ryan; Giuseppe Mantovani; Xuexuan Wang; David M. Haddleton; David J. Brayden. Advances in PEGylation of important biotech molecules: Delivery aspects. Expert Opinion on Drug Delivery. 2008, s. 371–383. PMID 18426380.
- F. Kawai. Microbial degradation of polyethers. Applied Microbiology and Biotechnology. 2002, s. 30–38. PMID 11831473.
- F. M. Veronese. Peptide and protein PEGylation: A review of problems and solutions. Biomaterials. 2001, s. 405–417. PMID 11214751.
- J. González-Valdez, M. Rito-Palomares, J. Benavides, Advances and trends in the design, analysis, and characterization of polymer–protein conjugates for “PEGylaided” bioprocesses, Anal. Bioanal. Chem. 403 (2012) 2225–2235. doi:10.1007/s00216-012-5845-6.
- G. Zhang, B. Han, X. Lin, X. Wu, H. Yan, Modification of Antimicrobial Peptide with Low Molar Mass Poly(ethylene glycol), J. Biochem. (Tokyo). 144 (2008) 781–788. doi:10.1093/jb/mvn134. [19] S. Obuobi, Y. Wang, J.S. Khara, A. Riegger, S.L. Kuan, P.L.R. Ee, Antimicrobial and Anti-Biofilm Activities of Surface Engineered Polycationic Albumin Nanoparticles with Reduced Hemolytic Activity, Macromol. Biosci. 18 (2018) 1800196. doi:10.1002/mabi.201800196.