Oxid jodičný
Oxid jodičný je anorganická sloučenina se vzorcem I2O5. Je to anhydrid kyseliny jodičné a jediný stabilní oxid jodu. Vyrábí se dehydratací kyseliny jodičné při teplotě 200 °C v proudu suchého vzduchu:
- 2 HIO3 → I2O5 + H2O
| Oxid jodičný | |
|---|---|
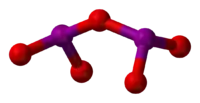
Tyčinkový model molekuly | |

Kalotový model molekuly | |
| Obecné | |
| Systematický název | Oxid jodičný |
| Ostatní názvy | anhydrid kyseliny jodičné |
| Anglický název | Iodine pentoxide Iodine(V) oxide Iodic anhydride |
| Německý název | Diiodpentoxid |
| Sumární vzorec | I2O5 |
| Vzhled | bílá hygroskopická krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 12029-98-0 |
| PubChem | 159402 |
| SMILES | O=I(=O)OI(=O)=O |
| InChI | 1S/I2O5/c3-1(4)7-2(5)6 |
| Vlastnosti | |
| Molární hmotnost | 333,81 g/mol |
| Teplota rozkladu | 300 °C (573 K) |
| Hustota | 4,980 g/cm3 |
| Rozpustnost ve vodě | rozpustný |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v kyselině dusičné, nerozpustný v ethanolu |
| Rozpustnost v nepolárních rozpouštědlech |
nerozpustný v diethyletheru a CS2 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Struktura
I2O5 má vazebný úhel I-O-I o velikosti 139,2°, ale molekula není zrcadlově symetrická. Koncové vazby I-O mají délku kolem 180 pm a vazby vycházející z prostředního atomu kyslíku jsou přibližně 195 pm dlouhé.
Reakce
Oxid jodičný snadno již za pokojové teploty oxiduje oxid uhelnatý na oxid uhličitý:
- 5 CO + I2O5 → I2 + 5 CO2
Tuto reakci lze použít ke stanovení obsahu CO v plynném vzorku.
I2O5 tvoří s oxidem sírovým a S2O6F2 jodylové soli, ovšem s koncentrovanou kyselinou sírovou tvoří jodosylové soli.
Při zahřátí nad 300 °C se oxid jodičný rozkládá za vzniku plynného jodu a kyslíku.[2]
Reference
V tomto článku byl použit překlad textu z článku Iodine pentoxide na anglické Wikipedii.
- Iodine pentoxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- G. Baxter and G. Tilley, "A Revision of the Atomic Weights of Iodine and Silver," The Chemical News and Journal of Industrial Science; Volumes 99-100, Royal Society Anniversary Meeting, December 3, 1909, p. 276. (Google Books)

