Oktapeptid
Oktapeptidy jsou oligopeptidy s molekulou složenou z osmi molekul aminokyselin, které jsou vzájemně propojeny peptidovou vazbou.
Stejně jako většina peptidů se oktapeptidy nacházejí v živých organismech, ve kterých mají důležité funkce. Využívají se také ve farmakologii. Mnoho z těchto sloučenin je také vyráběno synteticky.
Lineární oktapeptidy
.svg.png.webp)
Lineární oktapeptidy mají aminokyselin vzájemně propojeny v řetězci prostřednictvím sedmi peptidových vazeb.
Adrenorfin
Adrenorfin, také známý jako metorphamid, je jedním z opioidních peptidů. V roce 1983 byl poprvé získán z lidského nádoru adnoidního feochromocytomu Japoncem Kensaku Mizuno a Američanem Christopherem J. Evansem. Adrenorfin se váže na μ- a κ-opioidní receptory.
.svg.png.webp)
Angiotensin II
Angiotensin II, dříve hypertenzin II, je peptidový hormon produkovaný enzymem konvertujícím angiotenzin z angiotenzinu I. V roce 1953 se americkému biochemikovi Leonardu T. Skeggsem podařilo dokázat, že tento oktapeptid se vytváří v krevní plazmě. Angiotensin II zvyšuje krevní tlak vazokonstrakcí, vykazuje stimulační účinky na glykogenolýzu v játrech, na opětovné vychytávání iontů sodíku v ledvinách, na uvolňování vazopresinu v mozku a na uvolňování kortikotropinu v hypofýze.
Cyklické oktapeptidy
Cyklické oktapeptidy vytvářejí pomocí osmé peptidové vazby kruh. U některých cyklických oktapeptidů vzniká kruh pomocí jiných kovalentních vazeb, například u hymenistatinu I.
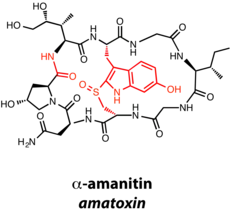
α-Amanitin
α-Amanitin patří do skupiny amatoxinů (dále beta-amanitin, gama-amanitin).
Jedná se o toxické cyklické oktapeptidy, které se vyskytují v některých houbách. α-Amanitin byl izolován z houby Amanita phalloides v roce 1941 německým chemikem Heinrichem Wielandem. A až v roce 1949, kdy byl objeven další toxin podobný amanitinu, se dostal na jméno α-amanitin.
Je inhibitorem RNA polymerázy II a pro tuto vlastnost se zkoumá jeho využití při léčbě rakoviny.
.svg.png.webp)
Hymenistatin-I
Hymenistatin-I byl izolován v roce 1989 americkým chemikem Georgem R. Pettitem z hub rodu Hymeniacidone. Jako cyklosporin inhibuje tento oktapeptid humorální a buněčnou imunitní odpověď.
.svg.png.webp)
Moroidin
Moroidin je cyklický oktapeptid, který má neobvyklý můstek mezi atomem N v imidazolu histidinu a atomem C v prstenci stélky tryptofanu. Druhý můstek se nachází mezi šestým a třetím uhlíkovým atomem téhož kruhu, třetí můstek je ve zbytku leucinu.
Molekuly moroidinu jsou obsaženy v kopřivách Laportea moroides a Dendrocnide moroides, ze kterých byly izolovány v roce 1985 britským biochemika Dudleyho H. Williamse. Moroidin je zodpovědný za bolest a zarudnutí po styku s kopřivou. Moroidin zabraňuje polymerizaci tubulinu, a je proto navržen jako nová třída inhibitorů mikrotubulů.
.svg.png.webp)
Oktreotid
Oktreotid je syntetický analog somatostatinua, také známý jako sandostatin®. Poprvé byl syntetizována v roce 1982. Struktura oktopeptidu ukazuje, že aminokyselina threonin byla redukována na dusíkatý alkohol - threoninol.
Oktreotid je farmakologicky aktivní a inhibuje mimo jiné uvolňování růstového hormonu somatropinu. Používá se například při symptomatické terapii gastroenteropakreatických nádorů. Dále bylo prokázáno, že podkožní oktreotid je účinný proti klastrovým bolestem hlavy.
Související články
Reference
V tomto článku byl použit překlad textu z článku Octapeptide na německé Wikipedii.