Octan stříbrný
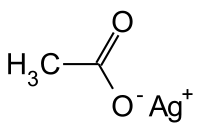
Octan stříbrný je stříbrná sůl kyseliny octové, jedna z mála ve vodě rozpustných stříbrných solí, se vzorcem CH3COOAg. Tato látka má nepříjemnou, kovovou chuť.
| Octan stříbrný | |
|---|---|
Vzhled | |
| Obecné | |
| Systematický název | Octan stříbrný |
| Funkční vzorec | CH3COOAg |
| Sumární vzorec | C2H3O2Ag |
| Vzhled | Bílý až našedlý prášek |
| Identifikace | |
| Registrační číslo CAS | 563-63-3 |
| Vlastnosti | |
| Molární hmotnost | 166,91 g/mol |
| Teplota rozkladu | 220 °C |
| Hustota | 3,26 g/cm3 |
| Rozpustnost ve vodě | 1 g/100 ml |
| Bezpečnost | |
| [1] Varování[1] | |
| NFPA 704 |  0
1
0
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Octan stříbrný lze vyrábět jednoduše reakcí stříbrných solí slabých kyselin, často uhličitanu stříbrného, s kyselinou octovou:
Ag2CO3 + 2CH3COOH → 2CH3COOAg + CO2 + H2O
Rovněž se tato látka dá připravit elektrolýzou kyseliny octové. Jako záporná elektroda (anoda) se užívá kovové stříbro, jako kladná elektroda se užívá zejména měď či stříbro (nebo jiný kov, který nereaguje s kyselinou octovou).
2CH3COOH → 2CH3COO− + 2H+
2H+ + 2e− → H2
2Ag -2e− → 2Ag+
2CH3COO− + 2Ag+ → 2CH3COOAg
Reakce
Při záření na tuto látku dochází k jejímu rozkladu na kovové stříbro, díky čemuž se mění barva do šeda. Vzniká acetátový aniont, který se rozkládá:
CH3COOAg ↔ CH3COO− + Ag+ → CH3COO + Ag
Při reakci s hydroxidem sodným probíhá reakce, na jejímž konci vzniká černá sraženina oxidu stříbrného:
2CH3COOAg + 2NaOH → 2CH3COONa + 2AgOH → 2CH3COONa + 2Ag2O + H2O
Užití
Tato látka se běžně užívá jako pesticid a rovněž se v malém množství přidává do cigaret za účelem odrazení od kouření. Tato látka se přidávala i do žvýkaček.
Reference
V tomto článku byl použit překlad textu z článku Silver acetate na anglické Wikipedii.
- Silver acetate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)

