Enantiomer
Enantiomery (nebo také optické antipody) jsou dvě látky, které mají stejný sumární vzorec i strukturní vzorec, prostorové uspořádání jejich molekuly jsou však zrcadlové obrazy a současně je nelze ztotožnit, jinými slovy mají se k sobě jako pravá a levá ruka (nemají rovinu symetrie), označují se proto jako vzájemně enantiomorfní.
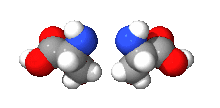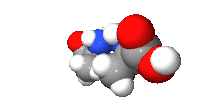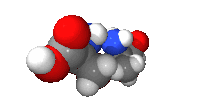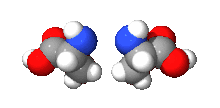
Většinou obsahují jeden nebo více chirálních atomů (zpravidla atomu uhlíku, který každou ze svých čtyř vazeb váže jinou skupinu). Enantiomery mají opačnou konfiguraci na všech chirálních centrech. Liší-li se jen na některých, jde o diastereomery (dva diastereomery nejsou vzájemně zrcadlovým obrazem), obecně jde o stereoizomery.
Enantiomery jsou opticky aktivní látky schopné stáčet rovinu polarizace světla.
Všechny aminokyseliny kromě glycinu a všechny sacharidy kromě dihydroxyacetonu tvoří enantiomery.
Názvosloví
V případě sacharidů a aminokyselin se enantiomery rozlišují prefixem L a D. Existuje též značení (+) a (−) odvíjející se od směru stáčení roviny polarizovaného světla látkou, není však doporučené v systematických názvech, protože přímo nesouvisí s konfigurací (strukturou).
V systematickém názvosloví se enantiomery (obecně diastereomery) rozlišují sadou deskriptorů chirálních atomů, R a S. Při pojmenovávání konkrétní látky nejprve označíme substituenty vycházející ze středu chirality čísly podle rostoucí důležitosti. Platí, že důležitost je dána relativní atomovou hmotností prvku, který se přímo váže na střed chirality. Pokud se na chirální uhlík váže více substituentů atomem stejného prvku a nemůžeme se tak rozhodnout o důležitosti hned v prvním kole, připočteme k relativní atomové hmotnosti prvního atomu substituentu všechny bezprostředně vázané atomy. Tak postupujeme dále, dokud se nedokážeme přesně rozhodnout, který ze substituentů je důležitější. Pokud z atomu vychází dvojná vazba (např. na kyslík), počítáme s tím, jako by tu byly atomy dva. Po očíslování substituentů vycházejících ze středu chirality začneme u atomu nebo skupiny s číslem 1. Pokud se důležitější ze sousedních substituentů nachází napravo od tohoto atomu, označíme látku jako R, pokud je nalevo, jedná se o S.
Vlastnosti
Základní fyzikální vlastností, kterou se optické izomery liší a která jim také dala název, je optická aktivita, tedy rozdílné stáčení roviny polarizovaného světla při průchodu látkou.
Chemickými vlastnostmi se optické izomery většinou příliš neliší. Výjimkou je pouze biologická aktivita. V živé hmotě se většinou nachází základní organické stavební látky (aminokyseliny, sacharidy) jen s jednou možnou konfigurací. Např. všechny aminokyseliny jsou v bílkovinách v L formě. Rozdílné optické izomery proto mohou rozdílně interagovat s enzymy, jejich účinky na živý organismus jsou tedy obecně odlišné. Z tohoto důvodu je v některých metabolických procesech aktivní pouze jedna forma chemických látek s optickou izomerií. Známým příkladem je vitamín C, L forma kyseliny askorbové. Někdy jsou biologicky aktivní obě formy, ale způsob zapojení do metabolických procesů a tedy i vliv na organismus se mohou velmi významně lišit; záměna forem může mít i fatální následky. Např. thalidomid, účinná látka z léku prodávaného mezi roky 1957 a 1961 v téměř 50 zemích jako antiemetikum proti těhotenským nevolnostem, jehož jeden enantiomer působí proti těhotenským nevolnostem, zatímco druhý enantiomer je teratogenní.
Optické izomery se také mohou vyznačovat odlišnými senzorickými vlastnostmi. Např. D-limonen má příjemnou pomerančovou vůni, L-limonen je cítit po terpentýnu.
Externí odkazy
 Obrázky, zvuky či videa k tématu optický izomer na Wikimedia Commons
Obrázky, zvuky či videa k tématu optický izomer na Wikimedia Commons