Nitrosobenzen
Nitrosobenzen je organická sloučenina se vzorcem C6H5NO patřící mezi nitrososloučeniny. Jedná se o světle zelenou látku, která se vyskytuje v rovnováze se světle žlutým dimerem. Monomer i dimer jsou diamagnetické.
| Nitrosobenzen | |
|---|---|
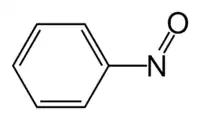
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | nitrosobenzen |
| Sumární vzorec | C6H5NO |
| Identifikace | |
| Registrační číslo CAS | 586-96-9 |
| PubChem | 11473 |
| SMILES | O=Nc1ccccc1 (monomer) c1ccccc1[N+](=O)N([O-])c1ccccc1 (dimer) |
| InChI | 1S/C6H5NO/c8-7-6-4-2-1-3-5-6/h1-5H |
| Vlastnosti | |
| Molární hmotnost | 107,11 g/mol |
| Teplota tání | 68,5 °C (341,6 K)[1] |
| Teplota varu | 59 °C (332 K) (2,4 kPa) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H301 H312 H332[1] |
| P-věty | P261 P264 P270 P271 P280 P301+310 P302+352 P304+312 P304+340 P312 P321 P322 P330 P363 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
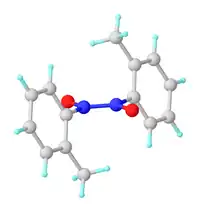
Rovnováha mezi monomerem a dimerem
Nitrosobenzen, stejně jako ostatní nitrosoareny, vytváří rovnováhu mezi monomerem a dimerem. Dimery obvykle převládají v pevném skupenství, monomery ve zředěných roztocích nebo za vyšších teplot. Dimery mají obecný vzorec Ar(O−)N+=N+(O−)Ar a mají cis- a trans-izomery, protože mezi atomy dusíku jsou dvojné vazby; někdy jsou dimery nazývány azobenzendioxidy. Cis-trans izomerizace probíhá skrz monomer.[2]
U nitrosobenzenu lze monomer připravit sublimací. Monomerní forma sublimuje přednostně díky své nižší molekulové hmotnosti a vytváří tmavě zelené krystaly. Postupem času monomer dimerizuje na azobenzen-N,N′-dioxid, což je světle žlutá pevná látka. V souladu s Le Chatelierovým principem je nitrosobenzen v roztoku přítomen jako směs monomeru a dimeru v dynamické rovnováze, jejíž složení závisí na teplotě (zvýšením teploty se posune ve prospěch monomeru) a koncentraci (monomer převažuje při nižších koncentracích) a použitém rozpouštědle.
Příprava
Nitrosobenzen poprvé připravil Adolf von Baeyer reakcí difenylrtuti s bromidem nitrosylu:[4]
- (C6H5)2Hg + BrNO → C6H5NO + C6H5HgBr
Novější postup spočívá v redukci nitrobenzenu na fenylhydroxylamin (C6H5NHOH), který je následně oxidován dichromanem sodným (Na2Cr2O7).[5]
Nitrosobenzen lze také připravit reakcí anilinu s kyselinou peroxosírovou[6] nebo peroxosíranem draseným.[7]
Přečištění se provádí sublimací nebo destilací s vodní parou, přičemž vzniká zelená kapalina, která se mění na bezbarvou pevnou látku.
Reakce
Nitrosobenzen se může účastnit Dielsových–Alderových reakcí s dieny.[8] kondenzačními reakcemi s aniliny se tvoří deriváty azobenzenu; tato reakce se nazývá Millsova reakce.[9] Redukce nitrobenzenů vede ke tvorbě anilinů.
Nejtypičtějšími reakcemi nitrosobenzenu jsou kondenzace s aktivními methylenovými skupinami, například s estery kyseliny malonové a fenylacetonitrilem. Fenylacetonitril (PhCH2CN) vytváří imin (PhC(CN)=NPh) v Ehrlichově-Sachsově reakci:[10]
- Ph–CH2-CN + Ph–NO → Ph–CH(CN)–N(OH)–Ph (oxyamination adduct) → PhC(CN)=N–Ph
Kondenzacemi s aktivními methyleny někdy vznikají produkty O-nitroso-aldolových reakcí:[11]
- R–CH2-CHO + Ph–NO → R–CH(CHO)–O–NHPh
Reference
V tomto článku byl použit překlad textu z článku Nitrosobenzene na anglické Wikipedii.
- Nitrosobenzene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- D. Beaudoin; J. D. Wuest. Dimerization of Aromatic C-Nitroso Compounds. Chemical Reviews. 2016, s. 258–286. DOI 10.1021/cr500520s. PMID 26730505.
- E. Bosch. Structural Analysis of Methyl-Substituted Nitrosobenzenes and Nitrosoanisoles. Journal of Chemical Crystallography. 2014, s. 44. DOI 10.1007/s10870-013-0489-8.
- A. Baeyer. Nitrosobenzol und Nitrosonaphtalin. Chemische Berichte. 1874, s. 1638–1640. Dostupné online. DOI 10.1002/cber.187400702214.
- G. H. Coleman; C. M. McCloskey; F. A. Stuart. Nitrosobenzene. Organic Syntheses. 1945, s. 80. DOI 10.15227/orgsyn.025.0080.
- H. Caro. Z. Angew. Chem.. 1898, s. 845ff.
- Beate Priewisch; Karola Rück-Braun. Efficient Preparation of Nitrosoarenes for the Synthesis of Azobenzenes. The Journal of Organic Chemistry. 2005, s. 2350–2352. ISSN 0022-3263. DOI 10.1021/jo048544x. PMID 15760229.
- H. Yamamoto, N. Momiyama "Rich Chemistry of Nitroso Compounds" Chemical Communications 2005, pp.3514–25.
- H. D. ANSPON. p-Phenylazobenzoic Acid. Org. Synth.. 1955. Dostupné online. (anglicky); Coll. Vol.. S. 711. (anglicky)
- H. Feuer. The Chemistry of the Nitro and Nitroso Groups Part 1.Chybí název periodika! New York: Wiley. S. 278–283.
- Asymmetric O− and N− Nitroso Aldol Reaction – an efficient access to a-oxy and a-amino carbonyl compound [online]. Dostupné online.

