Methyl-chlorformiát
Methyl-chlorformiát je ester kyseliny chlormravenčí a methanolu. Je to obvykle bezbarvá kapalina, starší vzorky však mohou být nažloutlé.
| Methyl-chlorformiát | |
|---|---|
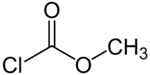
Strukturní vzorec | |
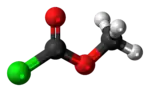
Model molekuly | |
| Obecné | |
| Systematický název | Methyl-karbonochloridát |
| Ostatní názvy | chlormravenčan methylnatý |
| Sumární vzorec | C2H3ClO2 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 79-22-1 |
| EC-no (EINECS/ELINCS/NLP) | 201-187-3 |
| PubChem | 6586 |
| SMILES | O=C(Cl)OC |
| InChI | 1S/C2H3ClO2/c1-5-2(3)4/h1H3 |
| Vlastnosti | |
| Molární hmotnost | 94,497 g/mol |
| Teplota tání | −61 °C (212 K)[1] |
| Teplota varu | 70,5 °C (343,6 K)[1] |
| Hustota | 1,479 g/cm3 |
| Disociační konstanta pKa | 4,14 |
| Rozpustnost ve vodě | málo rozpustný[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v chloroformu a ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v benzenu a diethyletheru[1] |
| Bezpečnost | |
| [2] Nebezpečí[2] | |
| H-věty | H225 H302 H312 H314 H330[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P260 P264 P270 P271 P280 P284 P301+312 P301+330+331 P302+352 P303+361+353 P304+340 P305+351+338 P310 P312 P320 P321 P322 P330 P363 P370+378 P403+233 P403+235 P405 P501[1] |
| Teplota vzplanutí | 17,8 °C (291,0 K)[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
Methyl-chlorformiát lze připravit reakcí methanolu s fosgenem:
COCl2 + CH3OH → ClCOOCH3 + HCl
Použití
Methyl-chlorformiát se používá v organické syntéze k připojování methoxykarbonylových skupin na nukleofily.[3]
Bezpečnost
Methyl-chlorformiát při zahřívání uvolňuje fosgen a za přítomnosti vody chlorovodík.
Odkazy
Související články
- Ethyl-chlorformiát
- Kyselina chlormravenčí
Externí odkazy
 Obrázky, zvuky či videa k tématu Methyl-chlorformiát na Wikimedia Commons
Obrázky, zvuky či videa k tématu Methyl-chlorformiát na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Methyl chloroformate na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/6586
- Methyl chloroformate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Emil Fischer. Synthesis of depsides, lichen-substances and tannins. Journal of the American Chemical Society. 1914, s. 1170–1201. DOI 10.1039/P19720001121.
Portály: Chemie
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.



