Meerweinova–Ponndorfova–Verleyova redukce
Meerweinova–Ponndorfova–Verleyova (MPV) redukce je organická chemická reakce spočívající v redukci ketonů a aldehydů na příslušné alkoholy za přítomnosti přídavného alkoholu a katalýzy hlinitými alkoxidy.[1]
MPV redukce se vyznačují vysokou chemoselektivitou a využívají kovové katalyzátory, které jsou levné a šetrné k životnímu prostředí.
 Meerweinova–Ponndorfova–Verleyova redukce |
Tuto reakci objevili Hans Meerwein a Rudolf Schmidt a nezávisle na nich A. Verley v roce 1925. Všimli si, že směs ethoxidu hlinitého a ethanolu může redukovat aldehydy na alkoholy.[2][3]
Wolfgang Ponndorf použil při této reakci ketony, kdy jako katalyzátor sloužil isopropoxid hlinitý v isopropylalkoholu.[4]
Mechanismus
Katalytický cyklus MPV redukce pravděpodobně zahrnuje šestičlenný cyklický meziprodukt. Na začátku je hlinitý alkoxid 1, na který se naváže karbonylový kyslík za vzniku tetrakoordinované sloučeniny hliníku 2. Přeměna z meziproduktu 2 na 3 probíhá přenosem hydridu z alkoxyligandu na karbonyl prostřednictvím pericyklické reakce. Nově vytvořený karbonyl se disociuje za vzniku trikoordinované sloučeniny hliníku 4. Nakonec alkohol použitý jako rozpouštědlo oddělí zredukovaný karbonyl a obnoví se katalyzátor 1.
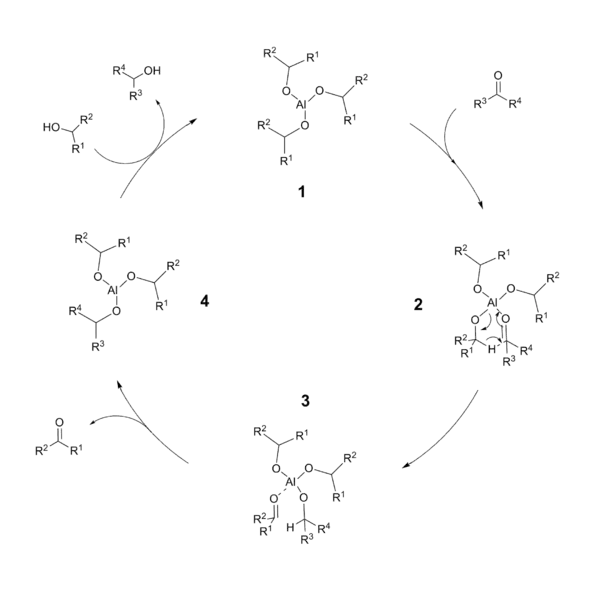 Katalytický cyklus Meerweinovy–Ponndorfovy–Verleyovy redukce |
Každý krok cyklu je vratný a průběh reakce je řízen termodynamickými vlastnostmi meziproduktů a produktů; v každém okamžiku se tak ve větší míře vytváří termodynamicky stabilnější produkt.
Bylo navrženo několik dalších mechanismů, například radikálový nebo mechanismus zahrnující deriváty alanu. Přímý přenos hydridu je obecně příjímán a podporují jej výsledky experimentů i teoretických studií.[5]
Chemoselektivita
Významnou vlastností Meerweinových–Ponndorfových–Verleyových redukcí je jejich chemoselektivita. Aldehydy se oproti ketonům redukují přednostně a je tak možné ovládat průběh reakce. Pokud je třeba redukovat jednu karbonylovou sloučeninu za přítomnosti jiné, tak lze použít běžné chránicí skupiny pro karbonyly. Lze použít i skupiny, jako jsou alkeny a alkyny, které často způsobují potíže u jiných postupů, protože za podmínek MPV redukcí nereagují.[6]
Stereoselektivita
Meerweinovy–Ponndorfovy–Verleyovy redukce lze provést u prochirálních ketonů, vznikají tak chirální alkoholy. Asymetrické MPV redukce mohou být uskutečněny pomocí chirálních alkoholů jako zdrojů hydridů, vnitromolekulárně nebo s využitím chirálních ligandů na hlinitém alkoxidu.
Jedním ze způsobů, jak provést MPV redukce asymetricky, je použít jako zdroje hydridových iontů chirální alkoholy; například u (R)-(+)-sec-o-bromfenethylalkoholu byl při redukci 2-chloracetofenonu dosažen 82% enantiomerní přebytek.[7]
Enantioselektivitu zde způsobují sterické efekty dvou fenylových skupin v šestičlenném meziproduktu. Na následujícím obrázku vzniká větší množství látky 1 než látky 2 z důvodu silných sterických efektů fenylových skupin u 2.
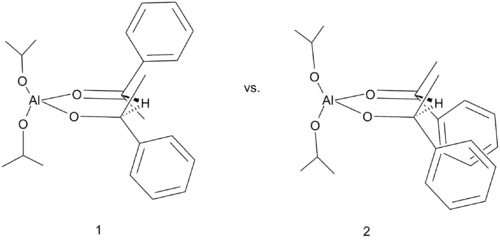 Meerweinova–Ponndorfova–Verleyova redukce s použitím chirálního alkoholu |
Použití vnitromolekulární MPV redukce může také vést k dobré enantiomerní čistotě.[8]
Při připevnění ketonu ke zdroji hydridu je možný pouze jeden přechodný stav, což vede k asymetrické redukci. V tomto procesu ovšem často probíhá také opačný děj, nazývaný Oppenauerova oxidace, protože oba reaktanty se nacházejí blízko k sobě. Při reakci se tak vytváří termodynamická rovnováha mezi příslušnými produkty, která závisí na jejich stabilitách. Po skončení reakce lze tento vedlejší produkt odstranit.
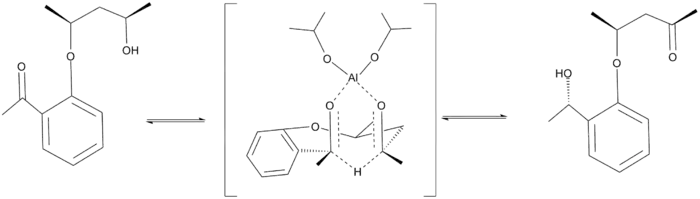 Vnitromolekulární Meerweinova–Ponndorfova–Verleyova redukce |
Chirální ligandy na hlinitém alkoxidu rovněž vedou k enantioselektivním redukcím, například u substituovaných acetofenonů lze dosáhnout enantiomerních přebytků až 83 %.[9]
Při této metodě se jako zdroj chirality používá ligand, namísto stechiometrické sloučeniny. Dosahované selektivity bývají nízké v důsledku tvaru přechodného stavu, který je rovinný a šestičlenný, čímž se liší od podoby, kterou předvídá Zimmermanův–Traxlerův model.[5]
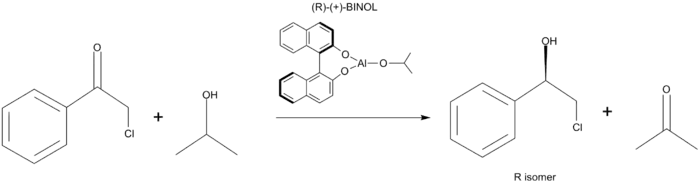 Meerweinova–Ponndorfova–Verleyova redukce s chirálním ligandem |
Možnosti
Využití Meerweinových–Ponndorfových–Verleyových redukcí omezuje několik faktorů. Stereochemii produktů mnohdy nelze dobře ovládat. U běžných reaktantů je často zapotřebí velké množství alkoxidu a dochází k několika vedlejším reakcím.
Isopropoxid hlinitý lze zakoupit, ovšem často vyžaduje použití 100-200 mol% katalyzátoru, což brání většímu využití MPV redukcí. Hlinité alkoxidy připravené in situ z trimethylhliníku mají lepší aktivitu a dostatečná bývají množství okolo 10 %. Předpokládá se, že rozdílnou aktivitu způsobuje značná míra shlukování u komerčně dostupných výrobků.[10]
Vedlejšími reakcemi jsou u ketonů a ještě více u aldehydů aldolové kondenzace. Aldehydy neobsahující α-vodíky se mohou účastnit Tiščenkových reakcí.[6] Alkoholy vytvořené redukcí jsou někdy dehydratovány.
Varianty
Meerweinova–Ponndorfova–Verleyova redukce byla použita na přípravu chirálních aminů z ketiminů pomocí chirálních alkoxidů. Navázání fosfinoylové skupiny na dusíkový atom ketiminu umožňuje dosáhnout vysoké enantioselektivity, s enantiomerním přebytkem až 98 %.[11]
Prozkoumáno bylo i možné využití lanthanoidů a přechodných kovů v MPV redukcích. Ruthenium a samarium poskytovaly při redukcích karbonylových sloučenin na alkoholy dobré výtěžnosti.[12][13] Rutheniový katalyzátor vytváří v průběhu reakce Ru-hydridový meziprodukt.
Meerweinovy–Ponndorfovy–Verleyovy redukce byly také se synteticky využitelnými výtěžky provedeny s isopropoxidem plutonitým.[14]
MPV redukce jsou obvykle homogenní, bylo však vyvinuto i několik heterogenních.[15]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Meerwein–Ponndorf–Verley reduction na anglické Wikipedii.
- A. L. Wilds. Reduction with Aluminum Alkoxides (The Meerwein-Ponndorf-Verley Reduction). Organic Reactions. 1944, s. 178-223. DOI 10.1002/0471264180.or002.05.
- Hans Meerwein; Rudolf Schmidt. Ein neues Verfahren zur Reduktion von Aldehyden und Ketonen. Justus Liebigs Annalen der Chemie. 1925, s. 221-238. DOI 10.1002/jlac.19254440112.
- A. Verley. Exchange of functional groups between two molecules. Exchange of alcohol and aldehyde groups. Bulletin de la Société Chimique de France. 1925, s. 537-542.
- Wolfgang Ponndorf. Der reversible Austausch der Oxydationsstufen zwischen Aldehyden oder Ketonen einerseits und primären oder sekundären Alkoholen anderseits. Angewandte Chemie. 1926, s. 138–143. DOI 10.1002/ange.19260390504.
- R. Cohen; C. R. Graves; S. T. Nguyen; J. M. L. Martin; M. A. Ratner. The Mechanism of Aluminum-Catalyzed Meerwein-Schmidt-Ponndorf-Verley Reduction of carbonyls to alcohols. Journal of the American Chemical Society. 2004, s. 14796–14803. DOI 10.1021/ja047613m. PMID 15535705.
- C. F. De Graauw; J. A. Peters; H. Van Bekkum; J. Huskens. Meerwein-Ponndorf-Verley Reductions and Oppenauer Oxidations: An Integrated Approach. Synthesis. 1994, s. 1007. DOI 10.1055/s-1994-25625.
- T. Ooi; T. Miura; K. Marouka. Highly Efficient, Catalytic Meerwein–Ponndorf–Verler Reduction with a Novel Bidentate Aluminum Catalyst. Angewandte Chemie International Edition. 1998, s. 2347-2349. DOI 10.1002/(SICI)1521-3773(19980918)37:17<2347::AID-ANIE2347>3.0.CO;2-U.
- M. Fujita; Y. Takarada; T. Sugimura; A. Tai. Reliable chiral transfer through thermodynamic equilibrium of the intramolecular Meerwein–Ponndorf–Verley reduction and Oppenauer oxidation. Chemical Communications. 1997, s. 1631-1632. DOI 10.1039/A704341D.
- E. J. Campbell; H. Zhou; S. T. Nguyen. The Asymmetric Meerwein-Schmidt-Ponndorf-Verley Reduction of Prochiral Ketones with iPrOH Catalyzed by Al Catalysts. Angewandte Chemie International Edition. 2002, s. 1020-1022. DOI 10.1002/1521-3773(20020315)41:6<1020::AID-ANIE1020>3.0.CO;2-S.
- E. J. Campbell; H. Zhou; S. T. Nguyen. Catalytic Meerwein-Pondorf-Verley Reduction by Simple Aluminum Complexes. Organic Letters. 2001, s. 2391-2393. DOI 10.1021/ol0162116. PMID 11463324.
- C. R. Graves; K. A. Scheidt; S. T. Nguyen. Enantioselective MSPV Reduction of Ketimines Using 2-propanol and (BINOL)AlIII. Organic Letters. 2006, s. 1229-1232. DOI 10.1021/ol060110w. PMID 16524310.
- D. A. Evans; S. G. Nelson; M. R. Gagne; A. R. Muci. A Chiral Samarium-Based Catalyst for the Asymmetric Meerwein–Ponndorf–Verley Reduction. Journal of the American Chemical Society. 1993, s. 9800-9801. DOI 10.1021/ja00074a057.
- K. Haack; S. Hashiguchi; A. Fujii; T. Ikariya. The Catalyst Precursor, Catalyst, and Intermediate in the RuII-Promoted Asymmetric Hydrogen Transfer between alcohols and Ketones. Angewandte Chemie International Edition in English. 1997, s. 285-288. DOI 10.1002/anie.199702851.
- Benjamin P. Warner; Joseph A. D’Alessio; Arthur N. Morgan. Plutonium(III)-catalyzed Meerwein–Ponndorf–Verley reactions. Inorganica Chimica Acta. 2000, s. 45-48. Dostupné online. DOI 10.1016/S0020-1693(00)00227-9.
- G. K. Chuah; S. Jaenicke; Y. Z. Zhu; S. H. Liu. Meerwein–Ponndorf–Verley reduction over Heterogeneous Catalysts. Current Organic Chemistry. 2006, s. 1639-1654. DOI 10.2174/138527206778249621.
Literatura
- Hans Meerwein; HINZ, Gerhard; MAJERT, Hermann; SÖNKE, Heinz. Über die Reduzierende Wirkung der Metallalkyle, insbesondere der Aluminium- und Bor-alkyle. J. Prakt. Chem.. 1936, s. 24. DOI 10.1002/prac.19361470608. (anglicky)DOI:10.1002/prac.19361470607DOI:10.1002/prac.19361470606