MTOR inhibitory
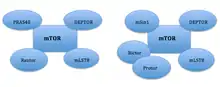
mTOR inhibitory jsou skupina léků, které inhibují jeden typ savčí serin/threoninové kinázy - protein mTOR patřící do rodiny kináz příbuzných fosfatidylinositol-3 kináze (tzv. PIKKs). mTOR reguluje buněčný metabolismus, růst a proliferaci signalizací přes dva proteinové komplexy, mTORC1 a mTORC2. Nejčastější skupinou mTOR inhibitorů jsou tzv. rapalogs (rapamycin a jeho analogy), které vyvolaly odezvu nádoru v klinických studiích .
Historie
mTOR byly objeveny před několika desítkami let při zkoumání mechanismu účinku jeho inhibitor, rapamycinu.[1] Samotný rapamycin byl objeven v roce 1975 ve vzorku půdy z Velikonočního ostrova z Jižního Pacifiku, známé také jako Rapa Nui, z čehož je odvozen jeho název .[2] Rapamycin je makrolid produkovaný mikroorganismem Streptomyces hygroscopicus s antimykotickými účinky. Krátce po jeho objevu byly zjištěny jeho imunosupresivní vlastnosti, což později vedlo k zavedení rapamycinu jako imunosupresiva. V roce 1980 byla objevena jeho protinádorová aktivita, i když přesný mechanismus účinku zůstává ještě dlouho neznámý.
V roce 1990 došlo k dramatické změně, neboť klinické studií zkoumaly mechanismus účinku rapamycinu a identifikovaly jeho působení. Bylo zjištěno, že rapamycin inhibuje buněčnou proliferaci a progresi buněčného cyklu. Rozšíření výzkumu mTOR inhibice má slibné výsledky.
Protein kinázy a jejich inhibitory
Obecně platí, že protein kinázy jsou zařazeny do dvou hlavních kategorií na základě jejich substrátové specifity, tj. na protein tyrosin kinázy a protein serin/threonin kinázy. Dualně-spevifické kinázy jsou podtřídy tyrosin kináz.[3]
mTOR je kinázou v rámci rodiny fosfatidylinositol-3 kinázy-související kináz (PIKKs), , která je rodina serin/threonin protein kináz a je sekvenčně podobná s rodinou lipidových kináz, PI3Ks. Tyto kinázy mají různé biologické funkce, jde vždy o velké proteiny se společnou doménovou strukturou.[4]
mTOR signální dráha
Zdá se, že množství růstových faktorů, aminokyselin, ATP a kyslíku jsou regulovány mTOR signalizací. Několik navazujících drah , které regulují progresi buněčného cyklu,[5] translaci, zahájení, transkripční reakce na stres,[6] protein stability a přežití buněk jsou signalizacány přes mTOR.
mTOR signální dráha u lidské rakoviny
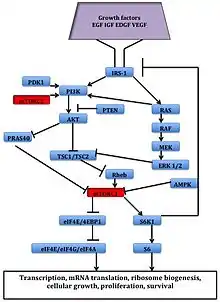
Mnoho lidských nádorů je způsobeno z důvodu dysregulace mTOR signalizace, proto může být léčba citlivá na inhibitory mTOR.[8] Deregulace několika prvků mTOR dráhy, jako je PI3K zesílení/mutace, ztráta funkce PTEN či zvýšená exprese AKT, S6K1, 4EBP1, a eIF4E byly spojeny s mnoha typy rakoviny. Proto, mTOR je zajímavý terapeutický cíl pro léčbu několika typů rakoviny, a to jak mTOR inhibitory samotné, nebo v kombinaci s inhibitory dalších cest.
Vývoj inhibitorů mTOR
Od objevu mTOR bylo provedeno mnoho práce, a to pomocí rapamycinu a rapalogů pro pochopení jeho biologických funkcí.[9][10] Klinické výsledky z cílení této dráhy nebyly tak přímočaré, jak se nejprve myslelo. Tyto výsledky změnily další klinický výzkum v této oblasti.
Zpočátku rapamycin byl vyvinut jako antimykotikum, lék proti Candida albicans, Aspergillus fumigatus a Cryptococcus neoformans.[11] Několik let později byly zjištěny jeho imunosupresivní vlastnosti. Novější studie vedly k zavedení rapamycinu jako hlavního imunosupresiva proti odmítnutí transplantátu, spolu s cyklosporinem A. Pomocí rapamycinu v kombinaci s cyklosporinem A došlo k lepší prevenci proti odmítnutí orgánu při transplantaci ledvin. Proto bylo možné použít nižší dávky cyklosporinu, což minimalizuje toxicitu léčby.
V roce 1980 rapamycin byl hodnocen NCI. Bylo zjištěno, že rapamycin má protinádorovou aktivitu a jedná se o necytotoxickou látku s cytostatickou aktivitou proti několika typům lidské rakoviny. Nicméně vzhledem k nepříznivým farmakokinetickým vlastnostem vývoj mTOR inhibitorů pro léčbu rakoviny nebyl úspěšný.[12] Následně bylo zjištěno, že rapamycin je efektivní pro prevenci ischemické restenózy a pro léčbu neurodegenerativních onemocnění.
Reference
V tomto článku byl použit překlad textu z článku MTOR inhibitors na anglické Wikipedii.
- STRIMPAKOS, Alex S.; KARAPANAGIOTOU, Eleni M.; SAIF, M. Wasif; SYRIGOS, Kostas N. The role of mTOR in the management of solid tumors: An overview. Cancer Treatment Reviews. 2009, s. 148–59. DOI 10.1016/j.ctrv.2008.09.006. PMID 19013721. (anglicky)
- TSANG, Chi Kwan; QI, Haiyan; LIU, Leroy F.; ZHENG, X.F. Steven. Targeting mammalian target of rapamycin (mTOR) for health and diseases. Drug Discovery Today. 2007, s. 112–24. DOI 10.1016/j.drudis.2006.12.008. PMID 17275731. (anglicky)
- LEMPIÄINEN, Harri; HALAZONETIS, Thanos D. Emerging common themes in regulation of PIKKs and PI3Ks. The EMBO Journal. 2009, s. 3067–73. DOI 10.1038/emboj.2009.281. PMID 19779456. (anglicky)
- LOVEJOY, Courtney A.; CORTEZ, David. Common mechanisms of PIKK regulation. DNA Repair. 2009, s. 1004–8. DOI 10.1016/j.dnarep.2009.04.006. PMID 19464237. (anglicky)
- COOPER, Geoffrey M. Regulators of Cell Cycle Progression. The Cell: A Molecular Approach. 2nd edition. 2000. Dostupné online [cit. 2019-03-12]. (anglicky)
- LJUNGMAN, Mats. The transcription stress response. Cell Cycle. 2007, s. 2252–7. DOI 10.4161/cc.6.18.4751. PMID 17700065. (anglicky)
- Lipton JO, Sahin M. The neurology of mTOR. Neuron. October 2014, s. 275–291. DOI 10.1016/j.neuron.2014.09.034. PMID 25374355. (anglicky)
Figure 1: Domain structure of the mTOR kinase and components of mTORC1 and mTORC2
Figure 2: The mTOR Signaling Pathway - HUANG, S; HOUGHTON, PJ. Targeting mTOR signaling for cancer therapy. Current Opinion in Pharmacology. 2003, s. 371–7. DOI 10.1016/S1471-4892(03)00071-7. PMID 12901945. (anglicky)
- VILAR, E.; PEREZ-GARCIA, J.; TABERNERO, J. Pushing the Envelope in the mTOR Pathway: The Second Generation of Inhibitors. Molecular Cancer Therapeutics. 2011, s. 395–403. DOI 10.1158/1535-7163.MCT-10-0905. PMID 21216931. (anglicky)
- BALLOU, Lisa M.; LIN, Richard Z. Rapamycin and mTOR kinase inhibitors. Journal of Chemical Biology. 2008, s. 27–36. DOI 10.1007/s12154-008-0003-5. PMID 19568796. (anglicky)
- FAIVRE, Sandrine; KROEMER, Guido; RAYMOND, Eric. Current development of mTOR inhibitors as anticancer agents. Nature Reviews Drug Discovery. 2006, s. 671–88. DOI 10.1038/nrd2062. PMID 16883305. (anglicky)
- YUAN, Ruirong; KAY, Andrea; BERG, William J; LEBWOHL, David. Targeting tumorigenesis: Development and use of mTOR inhibitors in cancer therapy. Journal of Hematology & Oncology. 2009, s. 45. DOI 10.1186/1756-8722-2-45. PMID 19860903. (anglicky)