Kyselina mléčná
Kyselina mléčná má kyselou chuť, je lehce rozpustná a tvoří bezbarvé krystaly s chemickým vzorcem CH3CH(OH)COOH. Po kyselině glykolové jde o druhou nejjednodušší hydroxykyselinu. Tato kyselina vzniká mléčným kvašením cukrů, např. v mléce, sýrech, kyselém zelí. Používá se proto v pekařství, pivovarnictví (E270), koželužství, k přípravě limonád a při barvení a zušlechťování textilií (pohmat, lesk). Většinou se vyskytuje jako opticky neaktivní (kyselina DL-mléčná).[2] Pro její antiseptické vlastnosti se požívá také v mastech, ústních vodách a jako prostředek k ošetřování vlasů. Její L-enantiomer[zdroj?] je koncovým produktem mléčného kvašení cukrů, a proto je přítomen v kyselém mléku a zelí. Konjugovaná báze kyseliny mléčné (její anion) se nazývá - CH3CH(OH)COO−.
| Kyselina mléčná | |
|---|---|
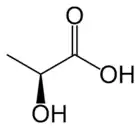
Strukturní vzorec L-mléčné kyseliny | |
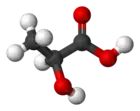
Prostorový model | |
| Obecné | |
| Systematický název | kyselina 2-hydroxypropanová |
| Triviální název | kyselina mléčná |
| Sumární vzorec | C3H6O3 |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 50-21-5 |
| 10326-41-7 (D) 79-33-4 (L) 598-82-3 (racemát) | |
| Vlastnosti | |
| Molární hmotnost | 90,08 g/mol |
| Teplota tání | 53 °C 17 °C (racemát) |
| Teplota varu | 122 °C (20 hPa) |
| Hustota | 1,209 g/cm3 |
| Disociační konstanta pKa | 3,86 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Laktát při tělesné námaze
Při silové zátěži, kdy jsou energetické nároky vysoké (anaerobní svalová práce), se laktát tvoří rychleji, než jak ho lze z tkáně odstraňovat a jeho koncentrace tak narůstá. Tento proces je užitečný, protože regenerace NAD+ zajišťuje, že lze udržet dodávku energie a svalová práce může pokračovat. Nadměrné množství laktátu lze odstranit různými způsoby, například:
- oxidací na pyruvát ve svalových buňkách za dostatečného množství kyslíku[zdroj?]
- Pyruvát lze přímo využít jako zdroj energie v Krebsově cyklu.
- konverzí na glukózu prostřednictvím glukoneogeneze v játrech a uvolněním zpět do oběhu; viz Coriho cyklus[3].
- Glukóza může být také využita na tvorbu jaterního glykogenu jakožto zásoby energie (pokud je potřeba zásobu doplnit).
V rozporu s velmi rozšířenou domněnkou nezpůsobuje tento nárůst přímo acidózu ani není odpovědný za pozdější svalovou bolest.[4] To proto, že laktát není sám schopen odštěpovat proton[4] a navíc kyselá forma laktátu (tedy kyselina mléčná) ve skutečnosti ani ve svalech nevzniká.[5] Analýza glykolytické dráhy člověka ukazuje, že v meziproduktech glykolýzy není k dispozici dost vodíkových iontů, aby vznikala mléčná či jakákoli jiná kyselina.
Odpovědnost laktátu za vznik acidózy byla a je předmětem mnoha konferencí na poli sportovní fyziologie. Robergs et al. přesně sledovali pohyb protonů během glykolýzy. Při tom však došli k hypotéze, že [H+][kdo?] je nezávislá proměnná, která určuje vlastní koncentraci. Čerstvá[kdo?] revize od Lindingera et al.[5] vyvrací stechiometrický přístup používaný Robergsovou skupinou.[4] Použitím tohoto stechiometrického procesu byly ignorovány kauzativní faktory (nezávislé proměnné) koncentrace vodíkových iontů ([H+]). Těmito faktory jsou diference silných iontů [SID], PCO2 a pufry slabých kyselin. Laktát je silný aniont a způsobuje redukci [SID], což má za následek zvýšení [H+], aby se udržela elektroneutralita. Také PCO2 způsobuje zvýšení [H+]. Během tělesné zátěže koncentrace laktátu a PCO2 stoupají, tím narůstá i [H+] a klesá pH.[6]. (Viz Le Chatelierův princip.)
Při intenzivní zátěži nemůže dýchací řetězec udržet dostatečný počet atomů vodíku, které by se mohly účastnit tvorby NADH. K udržení anaerobní produkce energie glykolýzou je potřeba mít NAD+, aby se dal oxidovat 3-fosfoglyceraldehyd. Při anaerobní glykolýze se NAD+ „osvobozuje“, zkombinují-li se nezoxidované atomy vodíku s molekulou pyruvátu a poté vytvoří laktát. Pokud k tomu nedojde, glykolýza se zastaví. Laktát se ovšem tvoří dál i při přestávce v zátěži nebo při jejím zmírnění. To je proto, že červené krvinky nemají mitochondrie a také kvůli omezením vyplývajícím z aktivity enzymů ve svalových vláknech s vysokou glykolytickou kapacitou.[7]
Použití
Kyselina mléčná je prekurzorem plastu kyseliny polymléčné (PLA). Ve farmacii a kosmetice se používá jako antibakteriální složka, na tvorbu ve vodě rozpustných mléčnanů (neboli laktátů) jinak nerozpustných účinných látek, pro úpravu pH, ale rovněž dobře slouží jako keratolytikum, tj. jako změkčovadlo staré až zrohovatělé kůže pro její snadné odstranění. Rovněž se používá v potravinářství jako přídatná látka pod označením E270, kdy zde slouží jako konzervant nebo ochucující složka, ovšem v mléčných produktech, především v kysaných (jogurt, kefír…) a sýrech se vyskytuje zcela přirozeně.

Reference
V tomto článku byl použit překlad textu z článku Lactic acid na anglické Wikipedii.
- Lactic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- PACÁK, Josef. Stručné základy organické chemie. Praha: SNTL, 1975. S. 205.
- MCARDLE, W. D., KATCH, F. I., & KATCH, V. L. Exercise physiology: Energy, nutrition, and human performance. [s.l.]: Wolters Kluwer/Lippincott Williams & Wilkins Health, 2010. ISBN 0683057316 9780683057317. (anglicky)
- ROBERGS, RA; GHIASVAND, F; PARKER, D. Biochemistry of exercise-induced metabolic acidosis. Am J Physiol Regul Integr Comp Physiol. 2004, s. R502–R516. Dostupné online. DOI 10.1152/ajpregu.00114.2004. PMID 15308499. (anglicky)
- LINDINGER, M. I. Applying physicochemical principles to skeletal muscle acid-base status. Am J Physiol Regul Integr Comp Physiol. 2004, s. R890–94. DOI 10.1152/ajpregu.00225.2005. (anglicky)
- ROBERGS, RA; GHIASVAND, F; PARKER, D. Biochemistry of exercise-induced metabolic acidosis. Am J Physiol Regul Integr Comp Physiol. 2004, s. R502-R516. DOI 10.1152/ajpregu.00114.2004. PMID 15308499. (anglicky)
- MCARDLE, KATCH & KATCH. Exercise Physiology: Energy, Nutrition, and Human Performance. [s.l.]: Wolters Kluwer/Lippincott Williams & Wilkins Health, 2010. ISBN 0683057316 9780683057317. (anglicky)
Literatura
- kyselina mléčná, Výkladový slovník biochemických pojmů, vydavatelstvi.vscht.cz
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina mléčná na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina mléčná na Wikimedia Commons  Encyklopedické heslo Mléčná kyselina v Ottově slovníku naučném ve Wikizdrojích
Encyklopedické heslo Mléčná kyselina v Ottově slovníku naučném ve Wikizdrojích

