Kyselina uhličitá
Kyselina uhličitá je slabá, nestálá kyselina, existující jen ve formě svého málo koncentrovaného vodného roztoku. S kationty tvoří dva typy obvykle stabilních solí – uhličitany a hydrogenuhličitany.
| Kyselina uhličitá | |
|---|---|
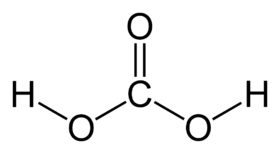
Strukturní vzorec | |
| Obecné | |
| Systematický název | kyselina uhličitá |
| Sumární vzorec | H2CO3 |
| Identifikace | |
| Registrační číslo CAS | 463-79-6 |
| Vlastnosti | |
| Molární hmotnost | 62,023 8 g/mol |
| Hustota | 1,668 g/cm3 |
| Disociační konstanta pKa | pK1: 6,35 pK2: 10,33 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
Připravuje se zaváděním oxidu uhličitého do vody, který se přitom z malé části slučuje s vodou na kyselinu uhličitou:
- CO2 + H2O ⇌ H2CO3.
Tato reakce je vratná a její rovnováha se dá snadno ovlivnit teplotou (s rostoucí teplotou klesá tvorba kyseliny uhličité), nebo parciálním tlakem oxidu uhličitého nad roztokem (při otevření láhve s vodou sycenou oxidem uhličitým se kyselina rozkládá a plynný oxid uhličitý v bublinkách uniká). Poslední teoretické výpočty však ukázaly, že za absolutní nepřítomnosti molekul vody jsou samostatné molekuly H2CO3 velmi stabilní, s poločasem rozpadu přibližně 180 000 let.[zdroj?]
Výskyt
V přírodě je kyselina uhličitá stálou složkou dešťových srážek a přírodní vody všeobecně. Je příčinou vzniku přechodné tvrdosti vody tím, že rozpouští uhličitanové minerály obsahující vápník a hořčík; stejný mechanismus je i podstatou vzniku krasových útvarů ve vápencových horninách. Vyšší obsah oxidu uhličitého a tím i kyseliny uhličité mají některé minerální vody. V živočišných organismech je významným meziproduktem v procesech výměny oxidu uhličitého mezi buňkami a krví.
Kyselina uhličitá je velmi slabá dvojsytná kyselina, která se jen částečně disociuje do prvního a ještě méně do druhého stupně:
- H2CO3 ⇌ H+ + HCO3– ⇌ 2H+ + CO32−
Tvoří dva typy solí uhličitany a hydrogenuhličitany (starší název kyselé uhličitany). Stálé hydrogenuhličitany tvoří pouze alkalické kovy a amoniak[zdroj?]. Hydrogenuhličitany kovů alkalických zemin existují jen ve vodných roztocích a jsou podstatou přechodné tvrdosti vody; zahřátím roztoku k bodu varu se rozkládají, např.:
Všechny uhličitany jsou iontové sloučeniny.
Mezi významné uhličitany a hydrogenuhličitany patří zejména:
- uhličitan sodný (bezvodá soda, Na2CO3);
- uhličitan sodný, dekahydrát (soda, Na2CO3 · 10H2O);
- hydrogenuhličitan sodný (jedlá soda, NaHCO3)
- uhličitan draselný (potaš, K2CO3);
- uhličitan amonný (cukrářské kvasnice, (NH4)2CO3);
- hydrogenuhličitan amonný (NH4HCO3).
Některé uhličitany jsou také známé minerály:
- uhličitan vápenatý (kalcit, jako hornina vápenec a mramor, CaCO3);
- uhličitan hořečnatý (magnezit, MgCO3);
- uhličitan hořečnatovápenatý (dolomit, CaMg(CO3)2);
- uhličitan zinečnatý (smithsonit, ZnCO3);
- uhličitan-dihydroxid diměďnatý (malachit, CuCO3 · Cu(OH)2);
- diuhličitan-dihydroxid triměďnatý (azurit, 2CuCO3 · Cu(OH)2);
- uhličitan železnatý (siderit čili ocelek, FeCO3).
Použití
Roztok oxidu uhličitého a kyseliny uhličité ve vodě je pod názvy sodová voda, sodovka nebo sifon podstatou součástí perlivých nápojů v potravinářství. Podzemní voda s obsahem nejméně 1 g rozpuštěného oxidu uhličitého v 1 litru je uhličitá minerální voda, tj. kyselka.
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina uhličitá na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina uhličitá na Wikimedia Commons