Kyselá katalýza
Kyselá katalýza je druh katalýzy, kdy je katalyzátorem kyselina. Podle Brønstedovy–Lowryho teorie je kyselinou donor protonu (vodíkového iontu, H+) a zásadou je akceptor protonu. K reakcím katalyzovaným přenosem protonu patří například esterifikace a aldolové reakce. Konjugovaná kyselina karbonylové skupiny je elektrofilnější než samotný karbonyl. V závislosti na konkrétním katalyzátoru může být mechanismus specifický nebo obecný. Enzymatické reakce většinou mají obecný mechanismus.
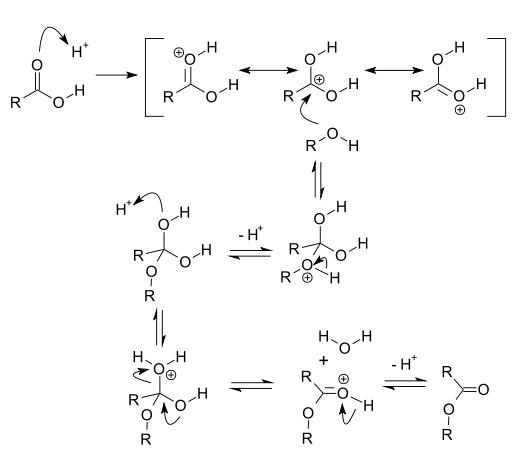
Použití a příklady
Brønstedovy kyseliny
Kyselá katalýza se obvykle používá u organických reakcí; jako zdroj protonů může být použito mnoho různých kyselin, jako jsou kyselina fluorovodíková (při alkylacích), fosforečná, p-toluensulfonová, polystyrensulfonát, heteropolykyseliny a zeolity.
Hydrolytické a transesterifikační reakce esterů, například při zpracovávání tuků na bionaftu, bývají katalyzovány silnými kyselinami.
Karbonylový kyslík je náchylný k protonaci, což zvyšuje elektrofilitu karbonylového uhlíku.
Pevné kyselé katalyzátory

V chemickém průmyslu se mnoho pochodů katalyzuje „kyselinami v pevném skupenství“, které se nerozpouští v reakční směsi. Jako příklady lze použít následující oxidy, fungující jako Lewisovy kyseliny: silikoalumináty (zeolity, oxid hlinitý, silikoaluminofosfáty), sulfatovaný oxid zirkoničitý a řadu přechodných kovů (například titaničitý, zirkoničitý a niobičný). Používají se též některé Brønstedovy kyseliny, například sulfonovaný polystyren, sulfonovaný uhlík,[1][2] pevná kyselina fosforečná, kyselina niobičná a heteropolyoxometaláty.[3]
Významnou oblastí využití tohoto způsobu katalýzy jsou alkylační reakce, například reakce benzenu s ethenem za vzniku ethylbenzenu. Další velké využití má přesmyk cyklohexanonoximu na kaprolaktam.[4] Mnoho alkylaminů se vyrábí a připravuje aminací alkoholů katalyzovanou pevnou kyselinou. Kyselina zde přeměňuje OH− na vodu, která je mnohem lepší odstupující skupinou. Kyseliny lze také použít na přeměnu alkoholů na jiné sloučeniny, například thioly.
Mechanismus
Jsou známy dva druhy mechanismu kyselé katalýzy, specifický a obecný.[5]
Specifická katalýza
Při specifické katalýze je katalyzátorem protonované rozpouštědlo. Rychlost reakce je přímo úměrná koncentraci protonovaných molekul rozpouštědla SH+.[6] Samotný kyselý katalyzátor (AH) reakci urychluje pouze posunem rovnováhy mezi S a AH ve prospěch SH+. Tento druh je běžný u silných kyselin v polárních rozpouštědlech jako je voda.
Ve vodném tlumivém roztoku rychlost reakce reaktantu R závisí na pH, ne však na koncentraci jednotlivých kyselin.
Tento druh chemické kinetiky se objevuje, pokud reaktant R1 rychle vytváří rovnováhu se svou konjugovanou kyselinou R1H+, která poté reaguje s R2 na konečný produkt; například při kysele katalyzované aldolové reakci.
Obecná katalýza
U obecné kyselé katalýzy mají na rychlost reakce vliv všechny složky reakční směsi schopné odštěpit protony.[7] Největší účinek mají silné kyseliny. K reakcím, při kterých je přenos protonu krokem určujícím rychlost, patří mimo jiné azokopulace.
Pokud je pH stálé, ale koncentrace pufru se mění, tak změna rychlosti reakce ukazuje na obecně katalytický mechanismu. Stálá rychlost dokazuje specifický mechanismus. Když se reakce provádí v nepolárních rozpouštědlech, tak je tento druh reakce důležitý, protože kyselina většinou není ionizována.
Enzymy katalyzované reakce probíhají obecným mechanismem.
Reference
V tomto článku byl použit překlad textu z článku Acid catalysis na anglické Wikipedii.
- Dharmesh R. Lathiya; Dhananjay V. Bhatt; Kalpana C. Maheria. Synthesis of sulfonated carbon catalyst from waste orange peel for cost effective biodiesel production. Bioresource Technology Reports. 2018, s. 69–76. Dostupné online. DOI 10.1016/j.biteb.2018.04.007.
- Gerardo Gómez Millán, Josphat Phir, Mikko Mäkelä, Thad Maloney, Alina M. Balu, Antonio Pineda, Jordi Llorca, Herbert Sixta. Furfural production in a biphasic system using a carbonaceous solid acid catalyst. Applied Catalysis A: General. 2019-09-05. Dostupné online. DOI 10.1016/j.apcata.2019.117180.
- Busca, Guido "Acid Catalysts in Industrial Hydrocarbon Chemistry" Chemical Reviews 2007, volume 107, 5366-5410. DOI:10.1021/cr068042e
- Michael Röper, Eugen Gehrer, Thomas Narbeshuber, Wolfgang Siegel "Acylation and Alkylation" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2000. DOI:10.1002/14356007.a01_185
- Lowry, T. H.; Richardson, K. S., "Mechanism and Theory in Organic Chemistry," Harper and Row: 1981. ISBN 0-06-044083-X
- The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.s05796. (anglicky) DOI: 10.1351/goldbook.
- The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.g02609. (anglicky) DOI: 10.1351/goldbook.