Polyoxometaláty
Polyoxometaláty (zkráceně POM) jsou ionty, obvykle anionty, které obsahují tři nebo více oxyanionty přechodných kovů propojené atomy kyslíku a uzavřené do trojrozměrných struktur. Atomy kovu obvykle patří některému z prvků 6. skupiny (Mo, W), méně často prvku 5. skupiny (V, Nb, Ta), ve vysokých oxidačních číslech. Tyto ionty jsou nejčastěji bezbarvé nebo oranžové a diamagnetické. Polyoxometaláty se dělí na dvě skupiny, izopolymetaláty, obsahující pouze jeden druh kovu a oxidu, a heteropolymetaláty, složené z kovu, oxidu a oxyaniontu prvku hlavní skupiny (například fosforečnanového nebo křemičitanového). Existuje řada výjimek z tohoto dělení.[1][2]
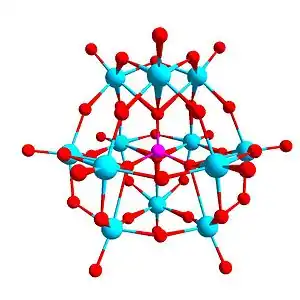
Příprava
Oxidy d0 kovů, například V2O5, MoO3 a WO3 se rozpouštějí v silně zásaditých roztocích za tvorby orthometalátů, VO 3−
4 , MoO 2−
4 a WO 2−
4 . U Nb2O5 a Ta2O5 nejsou vlastnosti roztoků při vysokých pH dobře známy, i tyto oxidy ovšem vytváří polyoxometaláty.
Snížení pH vede k protonaci orthometalátů, přičemž vznikají oxido-hydroxidy, jako jsou W(OH)O −
3 a V(OH)O 2−
3 . Tyto látky kondenzují v procesu zvaném olace. Nahrazením koncových vazeb M=O, které se ve skutečnosti chovají jako trojné vazby, je vyrovnáno navýšením koordinačního čísla. Skutečnost, že nebyly pozorovány polyoxochromanové klece bývá vysvětlována malými poloměry iontů Cr6+, které nemohou zaujmout oktaedrickou koordinační geometrii.[1]
Kondenzací M(OH)O n−
3 vede k odštěpení vody a tvorbě systémů vazeb M–O–M. Rovnice tvorby hexamolybdenanů vypadá takto:[3]
- 6 MoO42− + 10 HCl → [Mo6O19]2− + 10 Cl− + 5 H2O
Zkrácená posloupnost kondenzací u vanadičnanů vypadá takto:[1][4]
- 4 VO 3−
4 + 8 H+ → V4O 4−
12 + 4 H2O - 2,5 V4O 4−
12 + 6 H+ → V10O26(OH) 4−
2 + 2 H2O
Pokud se okyselení provede za přítomnosti fosforečnanu nebo křemičitanu, tak se vytvoří heteropolymetalát; Například anion PW12O 3−
40 se skládá ze sítě tvořené dvanácti oktaedrickými wolframanovými oxyanionty rozprostírajícími se kolem fosforečnanové skupiny.
Historie
V roce 1826 byl objeven fosfomolybdenan amonný, který obsahuje anion PMo12O 3−
40 .[5]
Roku 1934 byla pomocí rentgenové krystalografie určena struktura izostrukturního fosfowolframanového aniontu; tato struktura byla po svém objeviteli nazvána Kegginova struktura.[6]
V 70. letech 20. století byly vyvinuty kvartérní amoniové soli POM.[3] Tento objev umožnil systematický výzkum bez komplikací způsobovaných hydrolytickými a acidobazickými reakcemi. Zavedení 17O NMR spektroskopie usnadnilo zjišťování struktury POM roztocích.[7]
V roce 2016 byl objeven ramazzoit, první minerál obsahující polyoxometalátový kation.[8]
Struktura
Obvyklé stavební jednotky polyoxometalátů mají tvar mnohostěnů s šestikoordinovanými kovovými centry. Tyto bloky mají obvykle společné hrany a vrcholy. Koordinační čísla oxidových ligandů se liší v závislosti na jejich umístění ve struktuře. Povrchové atomy kyslíku jsou obvykle koncovými nebo dvojmůstkovými ligandy. Vnitřní kyslíkové atomy jsou většinou trojnásobně vázané nebo mají oktaedrickou geometrii.[1] POM se někdy zobrazují jako rozpustné fragmenty oxidů kovů.[7]
Polyoxometaláty lze dělit do skupin podle strukturních motivů. Iso-polyoxometaláty (isopolyanionty) mají oktaedrická kovová centra. Heteropolymetaláty vytvářejí odlišné struktury, protože centrum tvořené přechodným kovem je obvykle tetraedrické. U isopolyaniontů jsou časté Lindqvistovy a u heteropolyaniontů Kegginovy struktury.
 |
 |
 |
 |
 |
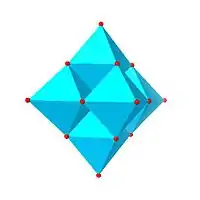
| Lindqvistův hexamolybdenan, Mo6O 2− 19 |
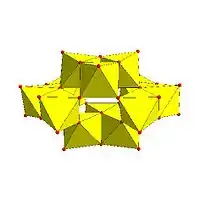
Dekavanadičnanový anion, V10O 6− 28 |
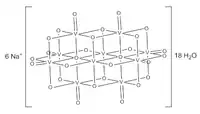
Struktura dekavanadičnanu sodného | Parawolframaman B, H2W12O 10− 42 |
Mo36-polymolybdenan, Mo36O112(H2O) 8− 16 |
Polymolybdenany a polywolframany
Polymolybdenany a polywolframany jsou, přinejmenším formálně, odvozeny od příslušných dianiontů, [MoO4]2− a [WO4]2−. Příslušná kovová centra jsou obvykle oktaedrická, někdy je tento tvar mírně narušen. Jsou také známy polymolybdenany obsahující pentagonálně bipyramidové struktury. Tyto bloky jsou součástí například molybdenových modří.[1]
Polyoxotantaličnany, polyoxoniobičnany a polyoxovanadičnany
Polyoxotantaličnany, polyoxoniobičnany a polyoxovanadičnany jsou odvozeny od iontů s obecným vzorcem [MO4]3−. U Nb a Ta se nejčastěji vyskytují sloučeniny se vzorcem M6 8−
16 (M = Nb, Ta), které zaujímají Lindqvistovy struktury. Tyto oktaanionty vznikají v silně zásaditých prostředích ze zásad rozpuštěných v oxidech typu M2O5, nebo u Nb také ze směsi kyseliny niobičné a vodných roztoků hydroxidů alkalických kovů. Hexatantaláty lze rovněž připravit kondenzací peroxotantaličnanů, Ta(O2) 3−
4 , v zásaditém prostředí.[9]
Tyto polyoxometaláty vykazují neobvyklé trendy co se rozpustnosti solí s alkalickými kovy týče, například jejich cesné a rubidné soli jsou lépe rozpustné než sodné a lithné soli. Opačný trend se vyskytuje u polyoxometalátů prvků 6. skupiny.[10]
Dekametaláty se vzorcem Nb10O 6−
28 jsou iszostrukturní s dekvanadičnany. Vznikají sdílením hran {MO6} oktaedrů (struktura dekawolframanu, W10O 4−
32 , obsahuje hrany i vrcholy společné vždy pro více oktaedrických wolframanových center).
Heteroatomy
Heteropolymetaláty obsahují jiné atomy než přechodné kovy. Funkci heteroatomu zde může mít řada různých prvků, nejběžnější jsou fosforečnany (PO 3-
4 ), křemičitany (SiO 4-
4 ) a arseničnany (AsO 3-
4 ).
Rozsáhlé struktury
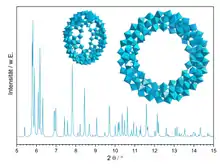
K polyoxomolybdenanům patří také aniony molybdenových modří, mající tvary podobné kolům, a kulovité kepleráty. Shluk [Mo154(NO)14O420(OH)28(H2O)70]~20− obsahuje více než 700 atomů a velikostí odpovídá malé bílkovinné molekule. Anion má tvar pneumatiky (dutina má průměr přes 2 nm) a velmi velký vnitřní i vnější povrch.
Oxoalkoxometaláty
Oxoalkoxometaláty jsou shluky obsahující oxidové i alkoxidové ligandy.[11] Obvykle v nich nejsou přítomné koncové oxoligandy. Příkladem mohou být dodekatitaničitan Ti12O16(OPri)16 (kde OPri je alkoxyskupina),[12] oxoalkoxometaláty železa[13]a železnaté[14] a měďnaté[15] Kegginovy ionty.
Sulfido-, imido- a jinak O-pozměněné oxometaláty
Koncová kyslíková centra polyoxometalátů lze někdy nahradit jinými ligandy, například S2−, Br− a NR2−.[5][16]
POM se sirnými skupinami se nazývají polyoxothiometaláty. Oxidové ionty je také možné nahradit nitrosylovými a alkoxyskupinami.[11][17]
Další skupinou polyoxometalátů jsou polyfluoroxometaláty.[18]
Použití
POM mají využití jako složky katalyzátorů organických oxidací.[23][24]
Ostatní možná využití
Velké rozpětí struktury, velikost a složení polyoxometalátů vede k mnoha různým vlastnostem a využitím těchto látek, příklady jsou tyto:
- Při umělé fotosyntéze mohou polyoxometaláty založené na mědi fungovat jako katalyzátory fotochemického štěpení vody a tvorby solárních paliv.[25]
- Katalytická epoxidace alkenů pomocí upravených stříbrných polyoxometalátů (Ag/Ag-POM) a zlata na barnaté soli POM jako katalyzátorů je průmyslově velmi významným postupem, protože epoxidy jsou důležitými meziprodukty při výrobě řady chemických látek a léčiv.
- Výroba potenciálních protinádorových léčiv a antivirotik.[26] Polyoxamolybdenany a heptamolybdenany Andersonova typu potlačují růst některých nádorů. U (NH3Pr)6[Mo7O24] se tato aktivita přičítá redoxním vlastnostem sloučeniny.[27][28]
- Využití mohou mít také magnetické[29] a optické[30] vlastnosti některých POM, jiné zase mají potenciální využití v lékařství, například při léčbě nádorů,[31] bakteriálních[32] a virových onemocnění.
- Léčiva založená na POM s Wellsovou–Dawsonovou strukturou inhibují hromadění amyloidu β (Aβ).[33]
Odkazy
Literatura
- LONG, D. L.; BURKHOLDER, E.; CRONIN, L. Polyoxometalate Clusters, Nanostructures and Materials: From Self-Assembly to Designer Materials and Devices. Chem. Soc. Rev.. 2007, s. 105–121. DOI 10.1039/b502666k. PMID 17173149. (anglicky)
- POPE, M. T.; MÜLLER, A. Polyoxometalate Chemistry: An Old Field with New Dimensions in Several Disciplines. Angew. Chem. Int. Ed. Engl.. 1991, s. 34–48. DOI 10.1002/anie.199100341. (anglicky)
- HILL, C. L. Special Volume on Polyoxometalates. Chem. Rev.. 1998, s. 1–2. DOI 10.1021/cr960395y. PMID 11851497. (anglicky)
- Special Issue on Polyoxometalates. Redakce Cronin L.. Chem. Soc. Rev.. 2012, s. 7325–7648. DOI 10.1039/C2CS90087D. PMID 23052289. (anglicky)
Reference
V tomto článku byl použit překlad textu z článku Polyoxometalate na anglické Wikipedii.
- N. N. Greenwood; A. Earnshaw. Chemistry of the Elements. Oxford: Butterworth-Heinemann, 1997. ISBN 978-0-7506-3365-9.
- M. T. Pope. Heteropoly and Isopoly Oxometalates. New York: Springer Verlag, 1983. Dostupné online.
- W. G. Klemperer. Tetrabutylammonium Isopolyoxometalates. Inorganic Syntheses. 1990, s. 74–85. DOI 10.1002/9780470132586.ch15.
- Nadiia I. Gumerova; Annette Rompel. Polyoxometalates in solution: speciation under spotlight. Chemical Society Reviews. 2020. Dostupné online. ISSN 0306-0012. DOI 10.1039/D0CS00392A.
- P. Gouzerh; M. Che. From Scheele and Berzelius to Müller: polyoxometalates (POMs) revisited and the "missing link" between the bottom up and top down approaches. L'Actualité Chimique. 2006, s. 9.
- J. F. Keggin. The Structure and Formula of 12-Phosphotungstic Acid. Proceedings of the Royal Society A. 1934, s. 75–100. DOI 10.1098/rspa.1934.0035. Bibcode 1934RSPSA.144...75K.
- V. W. Day; W. G. Klemperer. Metal Oxide Chemistry in Solution: The Early Transition Metal Polyoxoanions. Science. 1985, s. 533–541. DOI 10.1126/science.228.4699.533.
- Anthony R. Kampf; George R. Rossman; Chi Ma; Donato Belmonte; Cristian Biagioni; Fabrizio Castellaro; Luigi Chiappino. Ramazzoite, [Mg8Cu12(PO4)(CO3)4(OH)24(H2O)20][(H0.33SO4)3(H2O)36], the first mineral with a polyoxometalate cation. European Journal of Mineralogy. 2018-04-04, s. 182–186. Dostupné online [cit. 2018-05-21]. DOI 10.1127/ejm/2018/0030-2748. Bibcode 2018EJMin..30..827K.
- L. B. Fullmer; P. I. Molina; M. R. Antonio; M. Nyman. Contrasting ion-association behaviour of Ta and Nb polyoxometalates. Dalton Transactions. 2014, s. 15295–15299. DOI 10.1039/C4DT02394C. PMID 25189708.
- ANDERSON, T. M.; THOMA, S. G.; BONHOMME, F.; RODRIGUEZ, M. A.; PARK, H.; PARISE, J. B.; ALAN, T. M. Lithium Polyniobates. A Lindqvist-Supported Lithium−Water Adamantane Cluster and Conversion of Hexaniobate to a Discrete Keggin Complex. Crystal Growth & Design. 2007, s. 719–723. DOI 10.1021/cg0606904. (anglicky)
- Michael Thor Pope; Achim Müller. Polyoxometalates: From Platonic Solids to Anti-Retroviral Activity. [s.l.]: Springer, 1994. ISBN 978-0-7923-2421-8.
- V. W. Day; T. A. Eberspacher; W. G. Klemperer; C. W. Park. Dodecatitanates: a new family of stable polyoxotitanates. Journal of the American Chemical Society. 1993, s. 8469–8470. DOI 10.1021/ja00071a075.
- Avi Bino; Michael Ardon; Dongwhan Lee; Bernhard Spingler; Stephen J. Lippard. Synthesis and Structure of [Fe13O4F24(OMe)12]5−: The First Open-Shell Keggin Ion. Journal of the American Chemical Society. 2002, s. 4578–4579. DOI 10.1021/ja025590a. PMID 11971702.
- Omid Sadeghi; Lev N. Zakharov; May Nyman. Aqueous formation and manipulation of the iron-oxo Keggin ion. Science. 2015, s. 1359–1362. DOI 10.1126/science.aaa4620. PMID 25721507. Bibcode 2015Sci...347.1359S.
- A. Kondinski; K. Monakhov. Breaking the Gordian Knot in the Structural Chemistry of Polyoxometalates: Copper(II)–Oxo/Hydroxo Clusters. Chemistry: A European Journal. 2017, s. 7841–7852. DOI 10.1002/chem.201605876. PMID 28083988.
- R. John Errington; Richard L. Wingad; William Clegg; Mark R. J. Elsegood. Direct Bromination of Keggin Fragments To Give [PW9O28Br6]3−: A Polyoxotungstate with a Hexabrominated Face. Angewandte Chemie. 2000, s. 3884–3886. DOI 10.1002/1521-3773(20001103)39:21<3884::AID-ANIE3884>3.0.CO;2-M.
- P. Gouzerh; Y. Jeannin; A. Proust; F. Robert; S.-G. Roh. Functionalization of polyoxomolybdates: the example of nitrosyl derivatives. Mol. Eng.. 1993, s. 79–91. DOI 10.1007/BF00999625.
- Roy E. Schreiber; Liat Avram; Ronny Neumann. Self-Assembly through Noncovalent Preorganization of Reactants: Explaining the Formation of a Polyfluoroxometalate. Chemistry: A European Journal. 2018, s. 369–379. DOI 10.1002/chem.201704287. PMID 29064591.
- Y.-F. Song; D.-L. Long; L.Cronin. Non covalently connected frameworks with nanoscale channels assembled from a tethered polyoxometalate–pyrene hybrid. Angewandte Chemie International Edition. 2007, s. 3900–3904. DOI 10.1002/anie.200604734. PMID 17429852.
- Hong-Xu Guo; Shi-Xiong Liu. A novel 3D organic–inorganic hybrid based on sandwich-type cadmium heteropolymolybdate: [Cd4(H2O)2(2,2′-bpy)2] Cd[Mo6O12(OH)3(PO4)2(HPO4)2]2 [Mo2O4(2,2′-bpy)2]2·3H2O. Inorganic Chemistry Communications. 2004, s. 1217. DOI 10.1016/j.inoche.2004.09.010.
- Amir Blazevic; Annette Rompel. The Anderson–Evans polyoxometalate: From inorganic building blocks via hybrid organic–inorganic structures to tomorrows "Bio-POM". Coordination Chemistry Reviews. 2016, s. 42–64. DOI 10.1016/j.ccr.2015.07.001.
- D. D. Dexter; J. V. Silverton. A New Structural Type for Heteropoly Anions. The Crystal Structure of (NH4)2H6(CeMo12O42)·12H2O. Journal of the American Chemical Society. 1968, s. 3589–3590. DOI 10.1021/ja01015a067.
- Makoto Misono. Catalytic chemistry of solid polyoxometalates and their industrial applications. Mol. Eng.. 1993, s. 193–203. DOI 10.1007/BF0099963.
- Ivan V. Kozhevnikov. Catalysis by Heteropoly Acids and Multicomponent Polyoxometalates in Liquid-Phase Reactions. Chemical Reviews. 1998, s. 171–198. DOI 10.1021/cr960400y. PMID 11851502.
- BUVAILO, Halyna; MAKHANKOVA, Valeriya G.; KOKOZAY, Vladimir N.; OMELCHENKO, Irina V.; SHISHKINA, Svitlana V.; JEZIERSKA, Julia; PAVLIUK, Mariia V. Copper-containing hybrid compounds based on extremely rare [V2Mo6O26]6– POM as water oxidation catalysts. Inorganic Chemistry Frontiers. 2019, s. 1813–1823. ISSN 2052-1553. DOI 10.1039/C9QI00040B. (anglicky)
- Jeffrey T. Rhule; Craig L. Hill; Deborah A. Judd. Polyoxometalates in Medicine. Chemical Reviews. 1998, s. 327–358. DOI 10.1021/cr960396q. PMID 11851509.
- Bernold Hasenknopf. Polyoxometalates: introduction to a class of inorganic compounds and their biomedical applications. Frontiers in Bioscience. 2005, s. 275–287. DOI 10.2741/1527. PMID 15574368.
- Michael Pope; Achim Müller. Polyoxometalates: From Platonic Solids to Anti-Retroviral Activity - Springer. Topics in Molecular Organization and Engineering. 1994, s. 337–342. ISBN 978-94-010-4397-7. DOI 10.1007/978-94-011-0920-8.
- Achim Müller, Marshall Luban, Robert Modler, Paul Kögerler, Maria Axenovich, Jürgen Schnack, Paul Canfield, Sergey Budko, Neil Harrison. Classical and Quantum Magnetism in Giant Keplerate Magnetic Molecules. ChemPhysChem. 2001, s. 517–342. DOI 10.1002/1439-7641(20010917)2:8/9<517::aid-cphc517>3.0.co;2-1. PMID 23686989.
- Jürgen Schnack; Mirko Brüger; Marshall Luban; Paul Kögerler; Emilia Morosan; Ronald Fuchs; Robert Modler. Field-dependent magnetic parameters in Ni4Mo12: Magnetostriction at the molecular level?. Physical Review B. 2006, s. 094401. DOI 10.1103/physrevb.73.094401. Bibcode 2006PhRvB..73i4401S.
- Aleksandar Bijelic; Manuel Aureliano; Annette Rompel. Polyoxometalates as Potential Next‐Generation Metallodrugs in the Combat Against Cancer. Angewandte Chemie International Edition. 2019-03-04, s. 2980–2999. ISSN 1433-7851. DOI 10.1002/anie.201803868. PMID 29893459.
- Aleksandar Bijelic; Manuel Aureliano; Annette Rompel. The antibacterial activity of polyoxometalates: structures, antibiotic effects and future perspectives. Chemical Communications. 2018, s. 1153–1169. ISSN 1359-7345. DOI 10.1039/C7CC07549A. PMID 29355262.
- Nan Gao; Hanjun Sun; Kai Dong; Jinsong Ren; Taicheng Duan; Can Xu; Xiaogang Qu. Transition-metal-substituted polyoxometalate derivatives as functional anti-amyloid agents for Alzheimer's disease. Nature Communications. 2014-03-04, s. 3422. DOI 10.1038/ncomms4422. PMID 24595206. Bibcode 2014NatCo...5.3422G.