Křemičitan sodný
Křemičitan sodný je bílá (někdy našedlá, záleží na čistotě), krystalická, anorganická látka se vzorcem Na2SiO3.
| Křemičitan sodný | |
|---|---|

Vzhled | |
| Obecné | |
| Systematický název | Křemičitan sodný |
| Triviální název | vodní sklo |
| Sumární vzorec | Na2SiO3 |
| Vzhled | Bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 6834-92-0 |
| Vlastnosti | |
| Molární hmotnost | 122,06 g/mol |
| Teplota tání | 1 088 °C, (1 361 K) |
| Teplota varu | Rozklad (na SiO2 a Na2O) |
| Hustota | 2,4 g/cm3 |
| Rozpustnost ve vodě | rozpustný |
| Rozpustnost v polárních rozpouštědlech |
nerozpustný v ethanolu |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R34 R37 |
| S-věty | (S1/2) S13 S24/25 (S36/37/39) S45 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Průmyslově se tato látka vyrábí reakcí roztaveného hydroxidu sodného (při teplotě nad 320 °C) a oxidu křemičitého:
SiO2 + 2NaOH —t→ Na2SiO3 + H2O
Tato reakce probíhá pomalu, proto se za účelem zvýšení rychlosti provádí při zvýšené teplotě (probíhá i za normální teploty, avšak velice, velice pomalu) a oxid křemičitý se před vhozením nadrtí na jemný prášek.
Jinou možností výroby, pro kterou je zvýšená teplota také nezbytná, je reakce uhličitanu sodného s oxidem křemičitým. Tato možnost výroby je velice stará, bylo používáno sody a křemenů či písku. Reakce probíhá dle rovnice:
Na2CO3 + SiO2 —t→ Na2SiO3 + CO2
Reakce
Tato látka reaguje se zředěnými kyselinami, kupř. kyselinou sírovou, za vzniku kyseliny metakřemičité a síranu sodného. Kyselina křemičitá je rosolovitá látka, která se při nechání na vzduchu rozpadá na vodu a oxid křemičitý. Tímto způsobem je možno vytvářet velice čistý, práškovitý oxid křemičitý.
Na2SiO3 + H2SO4 → Na2SO4 + H2SiO3 ↔ Na2SO4 + SiO2 + H2O
Při reakci s rozpustnými solemi různých kovů (kupř. železité sloučeniny, měďnaté sloučeniny, zinečnaté sloučeniny, a mnoha jiných) vytváří sraženiny. Reakce probíhají dle rovince (jako příklad je použit chlorid zinečnatý):
ZnCl2 + Na2SiO3 → 2NaCl + ZnSiO3
Za normální teploty reaguje tato látka, za vzniku polykřemičitanu sodného. Toto se týká především roztoků, ve kterých se po čase začne usazovat vrstva takto vzniklého oxidu křemičitého.
nNa2SiO3 → 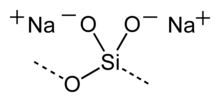
Použití
Dříve se tato látka používala na nakládání vajec; vejce se nakládaly do roztoku křemičitanu sodného, zvaného též vodní sklo (ze starého názvu fluid silica) ze 17. století. Vodní sklo je možno koupit v drogerii dodnes. Na výrobcích je někdy nejasně označován i jako "křemičitan sodný pentahydrát" (CAS 10213-79-3).
Dnes se používá křemičitan sodný ve stavebnictví a v čisticích prostředcích.
Tuto látku lze použít na ochranu materiálů (jelikož při zasychání vzniká vrstva polykřemičitanu sodného), takto lze ochránit kovy před korozí (v současnosti se za tímto účelem využívají laky). V případě nanesení vrstvy křemičitanu sodného na papír, papír ztvrdne. Zároveň se při tomto stane rezistentní proti ohni, při ohřívání na vysokou teplotu papír černá, při velmi vysoké teplotě se popraská vrstva oxidu křemičitého a materiál se rozpadá.
V čisticích prostředcích (např. tablety do myčky nebo prací prášky) se křemičitan sodný používá jako zdroj alkality, tj. upravuje pH na požadovanou hodnotu, při které dochází k účinnějšímu odstraňování některých nečistot, například mastnoty.
Reference
V tomto článku byl použit překlad textu z článku Sodium silicate na anglické Wikipedii.
- Sodium silicate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- SVOBODA, Luboš. Stavební hmoty (volně dostupná elektronická kniha). [s.l.]: [s.n.], 2013. Dostupné v archivu pořízeném dne 2013-10-16. ISBN 978-80-260-4972-2. S. 950. (anglicky)

