Oxid sodný
Oxid sodný (Na2O) je jediný oxid sodíku.
| Oxid sodný | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Oxid sodný |
| Anglický název | Sodium oxide |
| Německý název | Natriumoxid |
| Sumární vzorec | Na2O |
| Vzhled | bílý prášek nebo krystalky |
| Identifikace | |
| Registrační číslo CAS | 1313-59-3 |
| PubChem | 73971 |
| UN kód | 1825 |
| Vlastnosti | |
| Molární hmotnost | 61,978 9 g/mol |
| Teplota tání | 920 °C |
| Teplota varu | 1 275 °C (rozklad) |
| Hustota | 2,270 g/cm3 |
| Index lomu | nD= 1,478 - 1,500 |
| Rozpustnost ve vodě | reaguje (na NaOH) |
| Rozpustnost v polárních rozpouštědlech |
alkoholy (reaguje na alkoholáty) |
| Měrná magnetická susceptibilita | −4,021×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | krychlová |
| Hrana krystalové mřížky | a=555 m |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −416,1 kJ/mol |
| Entalpie tání ΔHt | 480 J/g |
| Standardní molární entropie S° | 75,3 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −376,3 kJ/mol |
| Izobarické měrné teplo cp | 1,177 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R14, R34 |
| S-věty | S8, S26, S30, S36/37/39, S45 |
| NFPA 704 |  0
3
4
W
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Vlastnosti
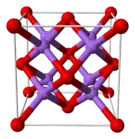
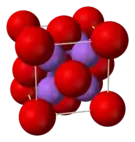
Je to za normálních podmínek bílá krystalická látka.[2] Její krystaly, podobně jako krystaly všech oxidů alkalických kovů, mají tzv. antifluoritovou strukturu, což znamená, že pozice aniontů a kationtů v krystalové mřížce jsou zcela obrácené, než je tomu u fluoridu vápenatého (CaF2). Sodíkové kationty tvoří středy tetraedrů, neboť jsou připojeny na 4 atomy kyslíku, zatímco kyslíkové atomy tvoří středy krychle, neboť jsou navázány na 8 sodíkových iontů.[3][4] Za vysokých teplot se rozkládá na peroxid sodný a sodík.[5]
S vodou bouřlivě reaguje za vzniku hydroxidu sodného[5] (je to vlastně jeho anhydrid):
Na2O + H2O → 2 NaOH |
|
Při kontaktu s očima, pokožkou a sliznicí dýchací soustavy je silně dráždivý a zejména prášková forma může snadno způsobit zdravotní potíže. Vdechnutí většího množství dokonce může vyvolat plicní edém.[5]
Příprava
Tento oxid je možné připravit např. reakcí oxidu dusného se sodíkem:[6]
N2O + 2Na → Na2O + N2 |
|
Taktéž je možné jej připravit tepelným rozkladem uhličitanu sodného:
Na2CO3 → Na2O + CO2 |
|
Použití
Oxid sodný se používá jako přísada při výrobě skla pro snížení teploty tavení oxidu křemičitého, který je hlavní složkou skla.
Reference
- Sodium oxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- WebElements Periodic Table of the Elements Sodium disodium oxide [online]. Dostupné online.
- Zintl, E.; Harder, A.; Dauth B. Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums. Z. Elektrochem. Angew. Phys. Chem.. 1934, roč. 40, s. 588–93.
- WELLS, A.F. Structural Inorganic Chemistry. Oxford: Clarendon Press, 1984. ISBN 0-19-855370-6.
- SODIUM OXIDE (ICSC) [online]. inchem.org. Dostupné online.
- PATNAIK, Pradyot. Handbook of Inorganic Chemical Compounds. [s.l.]: McGraw-Hill, 2003. Dostupné online.
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
