Fosfan
Fosfan je hydrid fosforu o vzorci PH3. Jeho molekula má tvar pyramidy s úhlem HPH = 93,5°. Čistý fosfan není samozápalný[zdroj?], vzněcuje se však díky přítomnosti stop difosfanu P2H4 nebo par bílého fosforu P4. Zapálen se oxiduje vzduchem a může tvořit výbušné směsi. Je velmi jedovatý. Na rozdíl od amoniaku NH3 není v kapalném stavu disociován a je jen nepatrně rozpustný ve vodě. Roztoky nejsou ani kyselé ani zásadité[zdroj?]. Reaguje však s některými kyselinami za vzniku fosfoniových solí.
- PH3 + HI → PH4I
| Fosfan | |
|---|---|
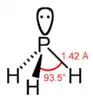
Strukturní vzorec | |

Tyčinkový model | |

Kalotový model | |
| Obecné | |
| Systematický název | fosfan |
| Ostatní názvy | fosfin fosforovodík |
| Anglický název | Phosphane |
| Německý název | Monophosphan |
| Sumární vzorec | PH3 |
| Vzhled | Bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7803-51-2 |
| EC-no (EINECS/ELINCS/NLP) | 232-260-8 |
| Indexové číslo | 015-181-00-1 |
| Vlastnosti | |
| Molární hmotnost | 33,998 g/mol |
| Teplota tání | −133,5 °C |
| Teplota varu | −87,43 °C |
| Hustota | 0,001 529 g/cm3 (0 °C) 0,746 g/cm³ (−90 °C) 0,896 g/cm3 (−135 °C) |
| Index lomu | 1,317 (−90 °C) |
| Kritická teplota Tk | 51,3 °C |
| Kritický tlak pk | 6 510 kPa |
| Rozpustnost ve vodě | 27 cm3/100 ml (20 °C) |
| Rozpustnost v polárních rozpouštědlech |
Rozpustný v ethanolu a diethyletheru |
| Rozpustnost v nepolárních rozpouštědlech |
Rozpustný v aromatických uhlovodících |
| Van der Waalsovy konstanty stavové rovnice | a=0,469 Pa m3mol−2 106•b= 51,56 m3mol−1 |
| Měrná magnetická susceptibilita | −329 Sm−1 |
| Ionizační energie | 9,98 eV |
| Struktura | |
| Krystalová struktura | Krychlová (pevná látka) |
| Hrana krystalové mřížky | a=630 pm |
| Koordinační geometrie | tetraedr |
| Tvar molekuly | Trigonální pyramida |
| Dipólový moment | 1,935×10−30 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 9,25 kJ/mol |
| Entalpie tání ΔHt | 33,2 J/g |
| Entalpie varu ΔHv | 429,7 J/g |
| Standardní molární entropie S° | 210,2 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | 13,4 kJ/mol |
| Izobarické měrné teplo cp | 1,091 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H220 H330 H314 H400 |
| R-věty | R12, R17, R26, R34, R50 |
| S-věty | S1/2, S28, S36/37, S45, S61, S63 |
| NFPA 704 |  4
3
2
|
| Teplota vznícení | 38 °C |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Fosfan je též silným redukčním činidlem a reaguje s roztoky mnoha kovových iontů za vzniku fosfidů. V zásaditém roztoku probíhá reakce:
- P + 3 H2O + 3 e → PH3 + 3 OH−.
Čistý plyn je bez zápachu, typický zápach technického fosfanu po rybině nebo česneku je způsoben nečistotami.[2]
Toxicita
Hlavní vstupní cestou do organismu je vdechování plynného fosfanu. Při požití kovových fosfidů (zejména hliníku a zinku) dochází v trávicím traktu k hydrolýze a uvolnění fosfanu. Vdechování plynu způsobuje silné podráždění plic, jejich edém, srdeční dysfunkci, excitaci CNS, kóma, případně smrt. Objevují se také zažívací potíže, poškození ledvin a leukopenie.[2]
Po požití fosfidů se objevuje podráždění vedoucí až k hemorrhagii, oběhový kolaps, neuropsychiatrické potíže, selhání dýchacích funkcí a ledvin. Později se může objevit poškození jater. Byla publikována řada zpráv o vysoké mortalitě (nad 50 %) u otrav fosfidy v Indii.[2] Fosfid zinečnatý se dříve všeobecně používal jako rodenticid. Nyní je jeho použití dle zákona o rostlinolékařské péči omezeno na profesionální použití. [3] Nákup je podmíněn odbornou způsobilostí pro 2. nebo 3. stupeň odborné způsobilosti pro nakládání s přípravky na ochranu rostlin podle § 86, 86a a 86b zákona č. 326/2004 Sb., o rostlinolékařské péči.
K smrti při otravě dochází obvykle do čtyř dnů, ale může k ní dojít za jeden nebo dva týdny. Posmrtné analýzy ukázaly infiltraci a nekrózu srdečního svalu, plicní edém a poškození malých cév.[2]
Chronická expozice způsobuje bolesti zubů, otok až nekrózu čelistí, slabost, ztrátu váhy, anémii a samovolné zlomeniny.[2]
Fosfan se z těla vylučuje jednak nezměněný ve vydechovaném vzduchu, a dále také močí v podobě fosfornanů a fosforitanů. Oxidace fosfanu v těle je pomalá. Fosfan denaturuje oxyhemoglobin a inhibuje řadu enzymů.[2]
Byly zaznamenány případy smrtelných otrav již při koncentraci fosfanu 1,2 mg/m3. Při požití fosfidu zinku nastala smrt již u dávky 4,5 g, naopak bylo hlášeno přežití i u dávky 50 g.[2]
U králíků se při koncentraci 70 mg/m3 po dobu 10 minut neobjevily žádné příznaky, ovšem expozice koncentraci 140 mg/m3 byla smrtelná během 2,5–3 hodin a při koncentraci 700 mg/m3 nastala smrt za 25–30 minut. Při podávání fosfidu zinku potkanům uhynulo 1 z 12 zvířat při 200 mg/kg a při 500 mg/kg 10 z 12 zvířat. Dávka 100 mg/kg a méně nebyla smrtelná, nicméně byl pozorován úbytek hemoglobinu a červených krvinek.[2]
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Fosfan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fosfan na Wikimedia Commons
Reference
- Phosphine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Phosphine - International Programme on Chemical Safety - Poisons Information Monograph 865
- ETIKETA RODENTICIDNÍHO PŘÍPRAVKU STUDOX I. Rev. 7.8.2019. Dostupné online.



