Fenothiazin
Fenothiazin, (zkráceně PTZ) je organická sloučenina se vzorcem S(C6H4)2NH, podobná heterocyklům ze skupiny thiazinů. Deriváty fenothiazinu jsou značně biologicky aktivní; například chlorpromazin se používá jako psychiatrické léčivo a promethazin slouží k léčbě alergií. Methylenová modř byla jedním z prvních známých antimalarik, její deriváty se zkoumají pro potenciálně protiinfekční účinky.
| Fenothiazin | |
|---|---|
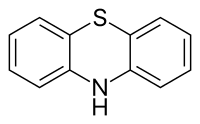
Strukturní vzorec | |

Model molekuly | |
| Obecné | |
| Systematický název | 10H-fenothiazin |
| Sumární vzorec | C12H9NS |
| Vzhled | žluté krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 92-84-2 |
| EC-no (EINECS/ELINCS/NLP) | 202-196-5 |
| PubChem | 7108 |
| ChEBI | 37931 |
| SMILES | c1ccc2c(c1)Nc3ccccc3S2 |
| InChI | 1S/C12H9NS/c1-3-7-11-9(5-1)13-10-6-2-4-8-12(10)14-11/h1-8,13H |
| Číslo RTECS | SN5075000 |
| Vlastnosti | |
| Molární hmotnost | 199,27 g/mol |
| Teplota tání | 187,5 °C (460,6 K)[1] |
| Teplota varu | 371 °C (644 K)[1] |
| Hustota | 1,34 g/cm3[1] |
| Disociační konstanta pKa | 2,52[1] |
| Rozpustnost ve vodě | 1,6*10−4 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v kyselině octové, ethanolu a acetonu, nerozpustný v chloroformu[1] |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v benzenu a diethyletheru[1] |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H302 H317 H373 H412[1] |
| P-věty | P260 P261 P264 P270 P272 P273 P280 P301+312 P302+352 P314 P321 P330 P333+313 P363 P501[1] |
| Teplota vzplanutí | 202 °C (475 K)[1] |
| Teplota vznícení | 471 °C (744 K)[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Fenothiazin byl poprvé připraven v roce 1883 reakcí difenylaminu se sírou,pozdější metody se zaměřují na cyklizaci 2-substituovaných difenylsulfidů. Z fenothiazinu se připravuje několik fenothiazinových léčiv.[2][3]
Fenothiaziny se chovají jako donory elektronů, přičemž mohou vytvářet soli s mnoha různými akceptory.
Použití
Samotný fenothiazin je pouze předmětem teoretického zájmu, jeho deriváty však přinesly výrazný pokrok do psychiatrie i ostatních lékařských odvětví a jiné deriváty byly zkoumány pro možné využití v bateriích a palivových článcích.[4]
Fenothiazinová léčiva
V roce 1876 objevil Heinrich Caro methylenovou modř, barvivo patřící mezi deriváty fenothiazinu. Jeho strukturu navrhl v roce 1885 Heinrich August Bernthsen, který také v roce 1883 připravil fenothiazin.[4] V 80. letech 19. století začal Paul Ehrlich používat methylenovou modř k barvení buněk při experimentech, za což získal část Nobelovy ceny; například barvil bakterie a parazity, jako jsou Plasmodiidae. Navrhl využití methylenové modři při léčbě malárie, provedl klinické testy a zavedl používání methylenové modři k tomuto účelu.[4]
Později se fenothiazin začal používat jako insekticid a anthelmintikum. Ve 40. letech 20. století chemický tým Paula Charpentiera začal připravovat deriváty fenothiazinu; tato činnost vedla k objevu promethazinu, který neměl žádné antiinfekční vlastnosti, ale fungoval jako antihistaminikum se silně sedativními účinky a byl prodáván jako lék na alergie a jako anestetikum; v roce 2012 se stále používal.[4] Na konci 40. let byl ve stejné laboratoři vytvořen chlorpromazin, který se ukázal jako ještě silnější sedativum; Jean Delay a Pierre Deniker jej vyzkoušeli na svých psychiatrických pacientech a na začátku 50 let zveřejnili výsledky studie. Jimi objevený silný účinek přinesl pokrok do psychiatrie a vedl ke zintezivnění výzkumu derivátů fenothiazinu.[4] Výzkum derivátů fenothiazinu a jejich aktivity byl jedním z prvních využití lékařské chemie.[4][5]
Fenothiaziny jsou největší z pěti základních skupin antipsychotik. Kromě antipsychotických mají často také antiemetické vlastnosti, ovšem též časté vedlejší účinky, jako jsou akatazie, tardivní dyskinezie a hyperprolaktinémie.[4] Používání fenothiazinů bývá spojováno s antifosfilipidovým syndromem, tyto souvislosti ale nebyly potvrzeny.[6]
Fenothiazinová antipsychotika se dělí na tři skupiny, které se rozlišují podle substituentů na atomu dusíku: alifatické (s acyklickými substituenty), piperidinové (obsahující skupiny odvozené od piperidinu) a piperazinové (s piperazinovými substituenty).[5]
| Skupina | Autonomní | Příklad | Sedativum | Extrapyramidální vedlejší účinky |
|---|---|---|---|---|
| Alifatické sloučeniny | ||||
| mírný | Chlorpromazin | silné | mírné | |
| Promazin | mírné | mírné | ||
| Triflupromazin | silné | mírné až silné | ||
| Levomepromazin | velmi silné | slabé | ||
| Piperidiny | silné | Mesoridazin | silné | slabé |
| Thioridazin | silné | slabé | ||
| Piperaziny | slabé | Flufenazin | slabé až mírné | silné |
| Perfenazin | slabé až mírné | silné | ||
| Prochlorperazin | ||||
| Trifluoperazin | mírné | silné |
Nelékařská použití
Řada ve vodě rozpustných fenothiazinových barviv, jako jsou methylenová modř, methylenová zeleň a thionin, může být elektropolymerizována za vzniku vodivých polymerů používaných jako elektrokatalyzátory oxidace NADH v enzymatických biosenzorech a biopalivových článcích.[7][8][9]
Fenothiazin funguje jako anaerobní inhibitor polymerizace kyseliny akrylové, čehož se často využívá při jejím přečišťování.[10]
Dřívější použití
Fenozhiazin se používal jako insekticid a jako anthelmintikum u lidí a hospodářských zvířat, byl však pro tyto účely nahrazen jinými látkami.
Fenothiazin byl zaveden jako insekticid v roce 1935.[11] Kvůli tomu, že se na světle a na vzduchu rozkládá bylo však obtížné určit množství, které je třeba použít, a tak byl ve 40. letech 20. století nahrazen jinými prostředky, jako je DDT.[12] K roku 2015 nebyl jako pesticid registrován ve Spojených státech amerických, Evropě[13] ani Austrálii.[14]
Použití fenothiazinu jako anthelmintika bylo zavedeno v roce 1940 a tato látka bývá, společně s thiabendazolem, považována za první moderní anthelmintikum.[15]
V roce 1961 byly zaznamenány první případy odolnosti vůči fenothiazinu.[15]
Ve 40. letech 20. století se fenothiazin začal používat jako anthelmintikum také u lidí; často byl podáván dětem rozpuštěný v čokoládě. V 50. letech byl nahrazen jinými léčivy.[4]
Odkazy
Externí odkazy
 Obrázky, zvuky či videa k tématu Fenothiazin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fenothiazin na Wikimedia Commons - MSDS
- Hendricks, Christensen, J.B., and Kristiansen, Jette E. Sonderborg, Denmark. "Antibakterielle Eigenschaften der Phenothiazine: Eine Behandlungsoption für die Zukunft?" Chemotherapie Journal. 13.5. (2004): 203–205. Wissenschaftliche Verlagsgesesellschaft mbH. 21 August 2005. (PDF).
- PubChem Substance Summary: Phenothiazine National Center for Biotechnology Information.
- CDC - NIOSH Pocket Guide to Chemical Hazards
Reference
V tomto článku byl použit překlad textu z článku Phenothiazine na anglické Wikipedii.
- Phenothiazine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Gérard Taurand, "Phenothiazine and Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005 DOI:10.1002/14356007.a19_387
- T. Kahl, K.-W. Schröder, F. R. Lawrence, W. J. Marshall, Hartmut Höke, Rudolf Jäckh, "Aniline" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH: Weinheim
- M. J. Ohlow; B. Moosmann. Phenothiazine: the seven lives of pharmacology's first lead structure. Drug Discovery Today. 2011, s. 119–131. DOI 10.1016/j.drudis.2011.01.001. PMID 21237283.
- Chemical structure of phenothiazines and their biological activity. Pharmacol Rep.. 2012, s. 16–23. Dostupné online. DOI 10.1016/s1734-1140(12)70726-0. PMID 21237283.
- Antiphospholipid Syndrome - Doctor's Information [online]. [cit. 2015-07-25]. Dostupné online.
- Qijin Chi; Shaojun Dong. Electrocatalytic oxidation of reduced nicotinamide coenzymes at Methylene Green-modified electrodes and fabrication of amperometric alcohol biosensors. Analytica Chimica Acta. 1994-01-20, s. 125–133. DOI 10.1016/0003-2670(94)85016-X.
- Arkady A. Karyakin; Elena E. Karyakina; Wolfgang Schuhmann; Hanns-Ludwig Schmidt. Electropolymerized Azines: Part II. In a Search of the Best Electrocatalyst of NADH Oxidation. Electroanalysis. 1999, s. 553–557. DOI 10.1002/(SICI)1521-4109(199906)11:8<553::AID-ELAN553>3.0.CO;2-6.
- Daria Sokic-Lazic; Shelley D. Minteer. Citric acid cycle biomimic on a carbon electrode. Biosensors and Bioelectronics. 2008, s. 939–944. DOI 10.1016/j.bios.2008.07.043. PMID 18774285.
- Leon B. Levy. Inhibition of acrylic acid polymerization by phenothiazine and p‐methoxyphenol. II. Catalytic inhibition by phenothiazine. Journal of Polymer Science Part A: Polymer Chemistry. 1992-03-30, s. 569–576. DOI 10.1002/pola.1992.080300407.
- http://www.clemson.edu/extension/pest_ed/histor.html History of Insecticides and Control Equipment] Clemson University Pesticide Information Program.
- G. Matolcsy, M. Nádasy, V. Andriska. Studies in Environmental Science: Pesticide Chemistry. Elsevier, 1989 ISBN 9780080874913
- ECHA phenothiazine at the European Chemicals Authority Archivováno 23. 1. 2019 na Wayback Machine
- Australian Pesticides and Veterinary Medicine Authority Phenothiazine Chemical Review Page accessed July 26, 2015
- Anthelmintic resistance in equine parasites--current evidence and knowledge gaps. Veterinary Parasitology. 2014, s. 55–63. DOI 10.1016/j.vetpar.2013.11.030. PMID 24433852.

