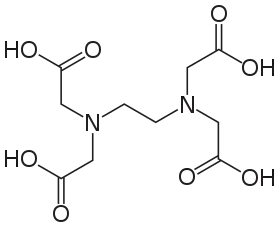
EDTA
EDTA je široce užívaná zkratka pro organickou sloučeninu kyselinu ethylendiamintetraoctovou (z angl. ethylenediaminetetraacetic acid), triviálně kyselinu edetovou (INN), případně její soli (edetáty, INN). EDTA je polyaminokarboxylová kyselina s chemickým vzorcem [CH2N(CH2CO2H)2]2. EDTA je běžně dostupná ve formě kyseliny (Chelaton 2, H4.EDTA), která je ve vodě jen málo rozpustná (0,4 g/l[2]), dobře rozpustné (96 g/l[3]) dihydrogensodné soli (chelaton 3, Na2H2.EDTA), výborně rozpustné (550 g/l[4]) (tetra)sodné soli (Na4.EDTA) a celé řadě solí jiných solí (Mn2+, Zn2+, Fe3+, Cu2+, Ca2+) používaných ve hnojivech (mikronutrienty). Vápenatosodná sůl EDTA (CaNa2.EDTA) se používá také jako potravinářské aditivum E385.
| EDTA | |
|---|---|
 | |
| Obecné | |
| Systematický název | 2,2′,2′′,2′′′-(ethan-1,2-diyldinitrilo)tetraoctová kyselina |
| Triviální název | edetová kyselina |
| Ostatní názvy | ethylenndiamintetraoctová kyselina; (ethylendinitrilo)tetraoctová kyselina; N,N′-ethan-1,2-diylbis[N-(karboxymethyl)glycin] |
| Latinský název | acidum edeticum |
| Anglický název | Ethylenediaminetetraacetic acid Edetic acid |
| Sumární vzorec | C₁₀H₁₆N₂O₈ a H₄EDTA |
| Identifikace | |
| Registrační číslo CAS | 60-00-4 |
| EC-no (EINECS/ELINCS/NLP) | 200-449-4 |
| PubChem | 6049 |
| ChEBI | 42191 |
| UN kód | 3077 |
| SMILES | OC(=O)CN(CC(=O)O)CCN(CC(=O)O)CC(=O)O |
| InChI | InChI=1S/C10H16N2O8/c13-7(14)3-11(4-8(15)16)1-2-12(5-9(17)18)6-10(19)20/h1-6H2,(H,13,14)(H,15,16)(H,17,18)(H,19,20) |
| Číslo RTECS | AH4025000 |
| Vlastnosti | |
| Molární hmotnost | 292,25 g/mol |
| Hustota | 0,860 g/cm3 (20 °C) |
| Disociační konstanta pKa | 2,0 2,7 6,16 10,26 |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −1765,4 až −1758,0 kJ/mol |
| Standardní molární spalná entalpie ΔH°sp | −4461,7 až −4454,5 kJ/mol |
| Bezpečnost | |
| [1] Varování[1] | |
| NFPA 704 |  0
1
0
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Využití
-ion.png.webp)
EDTA patří mezi chelatační činidla, což v praxi znamená, že je schopná vytvářet komplexní sloučeniny s ionty kovů. Toho se využívá například při odstraňování tvrdosti vody, což je hojně využíváno v pracích a mycích prostředcích (Ca2+ ionty jsou „polapeny“ chelátem a nesnižují tak účinnost mycího procesu, což se jinak děje ve velké míře). Takto chelatovaná vodní tvrdost je navíc dobře rozpustná a nedochází tak k usazování.
EDTA je také masově používáno v papírenském průmyslu při bezchlorovém bělení buničiny, kde vázáním polyvalentních iontů (zvláště Fe3+) stabilizuje peroxid používaný k bělení a výrazně tak podporuje účinnost procesu (Fe3+ jinak způsobuje katalytický rozklad peroxidů).
Oxidační vlastnosti FeIII-EDTA jsou také využívány ve fotografii, kde se používají k rozpouštění iontů stříbra. Je důležitou složkou ve fotografickém průmyslu jako okysličovadlo v barevných vývojkách. Jejích chelačních schopností se využívá i v buněčné biologii – je schopna rozrušit buněčné spoje vyžadující přítomnost iontů vápníku. V molekulární biologii se využívá jako součást řady pufrů, například TE pufru pro uchování DNA, ve kterých zajišťuje sekvestraci dvouvazebných iontů, které jsou nezbytné pro funkci DNáz, čímž brání degradaci DNA.
V medicíně se EDTA využívá při chelatační terapii, ve které slouží k odstranění těžkých kovů z těla.
V poslední době se stále více řeší nepříliš dobrá biologická rozložitelnost EDTA, která vede k hledání biologicky lépe rozložitelných alternativ.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku EDTA na anglické Wikipedii.
- Edetic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- https://www.sigmaaldrich.com/catalog/product/sial/e9884?lang=en®ion=US&cm_sp=Insite-_-caSrpResults_srpRecs_srpModel_mfcd00003541-_-srpRecs3-2
- https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/Product_Information_Sheet/e5134pis.pdf
- https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/Product_Information_Sheet/e6511pis.pdf
- Bezpečnostní listy k produktům Dissolvine Z (kyselina EDTA), Dissolvine NA2 (dihydrogensodná sůl EDTA), Dissolvine NA (sodná sůl EDTA) firmy AkzoNobel.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu EDTA na Wikimedia Commons
Obrázky, zvuky či videa k tématu EDTA na Wikimedia Commons - Lanigan RS, Yamarik TA. Final report on the safety assessment of EDTA, calcium disodium EDTA, diammonium EDTA, dipotassium EDTA, disodium EDTA, TEA-EDTA, tetrasodium EDTA, tripotassium EDTA, trisodium EDTA, HEDTA, and trisodium HEDTA. Int. J. Toxicol.. 2002, roč. 21 Suppl 2, s. 95–142. DOI 10.1080/10915810290096522. PMID 12396676.
- pH-Spectrum of EDTA complexes
- EDTA: Molecule of the Month
- EDTA Determination of Total Water Hardness
- 507 references regarding oral EDTA
- EDTA: the chelating agent under environmental scrutiny, Química Nova, Nov.-Dec., 2003 (text version)
- EDTA: the chelating agent under environmental scrutiny, Química Nova, Nov.-Dec., 2003 (PDF version)
