Dichlorsilan
Dichlorsilan (zkráceně DCS) je anorganická sloučenina odvozená od silanu náhradou dvou vodíkových atomů atomy chloru, se vzorcem SiH2Cl2. Ve směsi s amoniakem se používá k tvorbě nitridu křemičitého při zpracování polovodičů pomocí chemické depozice z plynné fáze. Vyšší podíly DCS ve směsi (například DCS : NH3 16 : 1) vedou většinou ke vzniku vrstev s menší odolností vůči mechanickému napětí.
| Dichlorsilan | |
|---|---|
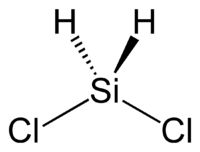
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | dichlorsilan |
| Ostatní názvy | DCS |
| Sumární vzorec | SiH2Cl2 |
| Vzhled | bezbarvý plyn[1] |
| Identifikace | |
| Registrační číslo CAS | 4109-96-0 |
| EC-no (EINECS/ELINCS/NLP) | 223-888-3 |
| PubChem | 61330 |
| SMILES | Cl[SiH2]Cl |
| InChI | 1S/Cl2H2Si/c1-3-2/h3H2 |
| Číslo RTECS | VV5950000 |
| Vlastnosti | |
| Molární hmotnost | 101,01 g/mol |
| Teplota tání | −122 °C (151 K)[1] |
| Teplota varu | 8 °C (281 K)[1] |
| Hustota | 1,22 g/cm3 |
| Rozpustnost ve vodě | rozkládá se[1] |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −320,49 kJ/mol |
| Standardní molární entropie S° | 286,72 J⋅K−1⋅mol−1 |
| Bezpečnost | |
| [1] | |
| H-věty | H220 H261 H280 H314 H318 H330 H331[1] |
| P-věty | P210 P231+232 P260 P261 P264 P271 P280 P284 P301+330+331 P303+361+353 Šablona:P304+340 P305+351+338 P310 P311 P320 P321 P363 P370+378 P377 P381 P402+404 P403 Šablona:P403+233 P405 P410+403 P501[1] |
| Teplota vzplanutí | −28 °C (245 K)[1] |
| Teplota vznícení | 55 °C (328 K) |
| Meze výbušnosti | 4,1 až 99 % |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Historie
Dichlorsilan byl poprvé připraven v roce 1919 reakcí plynného silanu, SiH4, s chlorovodíkem, HCl.[2] Bylo zjištěno, že plynný dichlorsilan reaguje s vodou za vzniku monomerního prosiloxanu, H2SiO. Prosiloxan se v kapalné fázi rychle polymerizuje, v plynné fázi je polymerizace pomalejší; tímto způsobem vznikají kapalné a pevné polysiloxany, [H2SiO]n. Kapalný produkt, který lze oddělit destilací za sníženého tlaku, se za pokojové teploty stává viskóznějším a poté vytváří gel. Následně byla provedena hydrolýza benzenového roztoku H2SiCl2 opatrným kontaktem s vodou a byla určena molární hmotnost podle poměrného zastoupení prvků v [H2SiO]6. Bylo určeno, že n ve vzorci (průměrný počet monomerových jednotek v polysiloxanu) je mezi 6 a 7. Dalším zkoumáním se zjistilo, že n se při rostoucí reakční době zvyšuje a při dostatečně dlouhém trvání reakce lze získat polymer, [HSi(OH)O]n.
Příprava a reakce
Většina dichlorsilanu vzniká jako vedlejší produkt při reakci chlorovodíku s křemíkem, jejímž hlavním produktem je trichlorsilan.
Disproporcionace trichlorsilanu je vhodnějším způsobem přípravy.[3]
- 2 SiHCl3 ⇌ SiCl4 + SiH2Cl2
Hydrolýza
Hydrolýzu dichlorsilanu lze provést reakcí jeho roztoku v benzenu s opatrně přidávaným přebytkem vody.[2][4] Ve velkém měřítku je vhodnější reakce ve směsi etheru a alkanu při 0 °C, při které vzniká směs těkavých a netěkavých [H2SiO]n. Pokusy provést hydrolýzu dichlorsilanu v hexanu pomocí NiCl2⋅6H2O jakožto zdroje vody nebyly úspěšné.[2] Podařilo se ji ovšem provést pomocí zředěného (C2H5)2O/CCl4 při −10 °C. Pokusy o provedení hydrolýzy byly prováděny za účelem přípravit koncentrované produkty a následnou destilací získat roztoky [H2SiO]n oligomerů v dichlormethanu.[2] Těmito postupy se připravují cyklické polysiloxany.
Dalším důvodem pro hydrolýzu dichlorsilanu je příprava lineárních polysiloxanů, což lze provést několika různými způsoby.[4] Hydrolýzou dichlorsilanu v diethyletheru, dichlormethanu nebo pentanu se mohou tvořit jak lineární, tak i cyklické polysiloxany.[4]
Přečištění
Dichlorsilan musí být pro využití při výrobě polovodičů získán jako velmi čistý.[3]
Výhody
Použití dichlorsilanu jako výchozího materiálu na přípravu tenkých polovodivých vrstev křemíku v mikroelektronice je oproti jiným látkám výhodné, protože k rozkladu dochází při nižší teplotě a tvorba krystalů křemíku je rychlejší.[3]
Bezpečnost
Dichlorsilan je reaktivní plyn, který se snadno hydrolyzuje a na vzduchu je samozápalný. Jedná se též o vysoce toxickou látku a při každém jejím používání se musí provádět preventivní měření.[6] Také může způsobit podráždění očí a kůže.[7]
Reference
V tomto článku byl použit překlad textu z článku Dichlorosilane na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/61330
- Seyferth, D., Prud’Homme, C., Wiseman, G., Cyclic Polysiloxanes from the Hydrolysis of Dichlorosilane, Inorganic Chemistry, 22, 2163–2167
- Vorotyntsev, V., Mochalov, G., Kolotilova, M., Kinetics of Dichlorosilane Separation from a Mixture of Chlorosilanes by Distillation Using a Regular Packing, Theoretical Foundations of Chemical Engineering, 38(4), 355-359
- Seyferth D., Prud’Homme C., Linear Polysiloxanes from Dichlorosilane, Inorganic Chemistry, 23, 4412-4417
- Walch, S., Dateo, C., Thermal Decomposition Pathways and Rates for Silane, Chlorosilane, Dichlorosilance, and Trichlorosilane, Journal of Physical Chemistry, 105, 2015–2022
- Vorotyntsev, V., Mochalov, G., Kolotilova, Volkova, E., Gas-Chromatographic and Mass-Spectrometric Determination of Impurity Hydrocarbons in Organochlorine Compounds and Dichlorosilane, Journal of Analytical Chemistry, 61(9), 883-888
- Praxair Material Safety Data Sheet (2007)



