Dialkylbiarylfosfinové ligandy
Dialkylbiarylfosfinové ligandy jsou skupinou organických ligandů, které mají v molekulách atomy fosforu a používají se k pozměňování reaktivity katalyzátorů obsahujících palladium nebo jiné přechodné kovy. Poprvé je popsal Stephen L. Buchwald v roce 1998 skrz jejich využití při reakcích katalyzovaných palladiem tvořících vazby uhlík-dusík a uhlík-uhlík.[1] Před objevem těchto ligandů se používaly katalyzátory založené na fosfinových ligandech první a druhé generace, jako například BINAP a tris(o-tolyl)fosfin, s nimiž se reakce musely provádět za tvrdších posmínek a spektrum použitelných substrátů bylo užší. Suzukiho-Mijaurova a Negišiho reakce se obvykle katalyzují Pd{P(C6H5)3}4 a lze je provádět pouze u arylbromidů a aryljodidů za vyšších teplot, zatímco široce dostupné chloridy jsou zde nereaktivní. K překonání těchto omezení bylo nutné vyvinout nový druh ligandů.
Od této doby byly vyvinuty další ligandy, které umožnily katalýzu mnoha různých reakcí, jako jsou Buchwaldova–Hartwigova aminace, etherifikační, Negišiho a Suzukiho-Mijaurova reakce.[2]
Dialkylbiarylfosfinové ligandy se používají velmi často, protože je lze použít na velký počet různých substrátů. Deriváty látky BrettFos umožňují katalýzu reakcí aryl(pseudo)halogenidů s jinak těžko použitelnými substráty, jako jsou například organofluoridy, trifluormethylové sloučeniny, dusitany (při přípravě nitroarenů) a kyanáty (při přípravě močoviny z izokyanátů). Lze je také použít při reakcích katalyzovaných jinými přechodnými kovy, například zlatem, stříbrem, mědí, rutheniem a rhodiem.[3]
Vlastnosti
Dialkylbiarylfosfinové ligandy jsou krystalické látky, na vzduchu stálé. Mnoho z nich lze zakoupit nebo v několika málo krocích připravit v laboratoři.[4][5]

Vyšší katalytická aktivita komplexů těchto ligandů oproti jiným je způsobována vysokou elektronovou hustotou, sterickými jevy a několika specifickými strukturami. Jako objemné skupiny dodávající elektrony se používají například cyklohexylové, t-butylové a adamantylové skupiny. Níže zobrazené benzenové jádro, v poloze ortho vůči fosfinové skupině, má také na aktivitu příslušných katalyzátorů významný vliv. Z několika krystalografických studií vyplývá, že se chová jako pololabilní ligand a v průběhu katalytického cyklu stabilizuje vysoce reaktivní dvanáctielektronový meziprodukt LPd(0). Později vyvinuté ligandy usnadňují 2,6-substituci na tomto cyklu, což zabraňuje rozkladu katalyzátoru palladiem řízenou aktivací vazby C-H. Dalšími menšími změnami ve struktuře ligandů lze dosáhnout značné změny aktivity při reakcích s různými substráty. Toto zjištění vedlo k vývoji ligandů používaných specificky pro konkrétní reakce.[4] Bylo vyvinuto několik generací cyklopalladiových prekatalyzátorů, které lze používat za pokojové, a často ještě nižší, teploty a tím byly rozšířeny možnosti jejich použití.[6][7]
Níže jsou popsané některé používané dialkylbiarylfosfinové ligandy, seřazené podle přibližné doby objevu.
DavePhos
DavePhos byl prvním známým dialkylbiarylfosfinovým ligandem, původně používaným při katalýze Suzukiho-Mijaurových reakcí a Buchwaldových-Hartwigových aminací,[1] později i u dalších reakcí, jako například arylací ketonů[8] a esterů,[9] borylací arylchloridů[10] a arylací indolů.[11]
JohnPhos
JohnPhos byl poprvé použit v roce 1999 při palladiem katalyzovaných Suzukiho-Mijaurových reakcích arylbromidů a arylchloridů.[12] Při jeho použití mohou stericky ovlivněné substráty za pokojové teploty reagovat za přítomnosti velmi malého množství katalyzátoru. Díky tomu má využití v reakcích, jako jsou aminace arylhalogenidů a triflátů[13][14] a arylace thiofenů.[15]
Bylo také zkoumáno několik obměn tohoto ligandu, jako jsou PhJohnPhos a CyJohnPhos.
MePhos

MePhos, objevený v roce 1999, má podobné vlastnosti vzhledem k palladiem katalyzovaným Suzukiho-Mijaurovým reakcím jako DavePhos a JohnPhos.[12] Může vytvářet aktivní katalyzátor při syntéze arylketonů.[8][16]
Bylo zjištěno, že pro závěrečné kroky Suzukiho reakcí je nevhodnějším katalytickým systémem Pd2(dba)3/MePhos. Při této reakci byly použity kilogramová množství reaktantů a nebylo třeba odstraňovat palladium, jelikož s ním přebytečný imidazol vytvářel komplex, který bylo možné snadno odstranit.[17]

XPhos
XPhos byl poprvé použit v roxe 2003 k aminaci a amidaci arylsulfonátů a arylhalogenidů.[18] Rovněž jej lze použít při borylaci aryl- a heteroarylchloridů.[10]
Jsou známy i obměny této látky, jako například tBuXPhos a Me4tButylXPhos, které lze využít při přípravě diaryletherů.[19] Pokud se na tyto ligandy naváže do polohy 4 sulfonová skupina, tak mohou být použity v Sonogaširově reakci ve vodných dvoufázových rozpouštědlech.[20]
SPhos
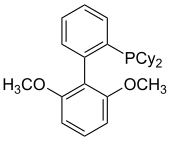
SPhos byl popsán roku 2004 jako ligand vhodný pro katalýzu Suzukiho-Mijaurových reakcí.[21]
RuPhos
RuPhos, byl popsán v roce 2004 jako součást vysoce aktivního katalytického systému palladiem katalyzovaných Negišiho reakcí organozinečnatých sloučenin s arylhalogenidy.[22] Umožňuje použití silně stericky zatížených substrátů i substrátů s mnoha různými funkčními skupinami. Ukázal se také účinným při trifluormethylacích arylchloridů[23] a aminacích arylhalogenidů.[24]
BrettPhos
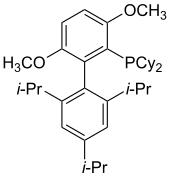
BrettPhos byl poprvé použit roku 2008, a to v aminacích arylmesylátů a arylhalogenidů katalyzovaných palladiem.[25] Tento ligand zvyšuje reaktivitu slabých nukleofilů s arylhalogenidy. Je také velmi selektivní při monoarylaci primárních aminů, kdy téměř nedochází k tvorbě diarylovaných produktů; tato selektivita se neobjevuje u sekundárních aminů. BrettPhos lze rovněž použít při katalýze trifluormethylací arylchloridů,[23] syntéze aryltrifluormethylsulfidů[26] a Suzukiho-Mijaurových reakcích.[27]
Existuje několik obměn BrettPhosu, například tBuBrettPhos, vhodný na přeměny aryltriflátů a arylbromidů na příslušné arylfluoridy[28] i pro přípravu aromatických nitrosloučenin.[29] AdBrettPhos je možné využít k amidaci pětičlenných heterocyklických halogenderivátů obsahujících více heteroatomů (například halogenimidazolů a halogenpyrazolů).[30]
CPhos

CPhos se používá při Negišiho reakcích sekundárních alkylzinečnatých sloučenin s arylhalogenidy.[31]
AlPhos
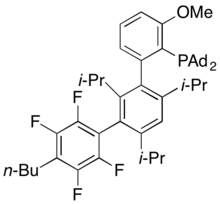
AlPhos, popsaný v roce 2015, je jedním z nejnověji používaných dialkylbiarylfosfinových ligandů.[32] Umožňuje provádět palladiem katalyzované fluorace aryl- a heteroaryl triflátů za mírných podmínek.[33]
Reference
V tomto článku byl použit překlad textu z článku Dialkylbiaryl phosphine ligands na anglické Wikipedii.
- David W. Old; John P. Wolfe; Stephen L. Buchwald. A Highly Active Catalyst for Palladium-Catalyzed Cross-Coupling Reactions: Room-Temperature Suzuki Couplings and Amination of Unactivated Aryl Chlorides. Journal of the American Chemical Society. 1998, s. 9722–9723. DOI 10.1021/ja982250+.
- David S. Surry; Stephen L. Buchwald. Dialkylbiaryl phosphines in Pd-catalyzed amination: a user's guide. Chemical Science. 2011, s. 27–50. ISSN 2041-6539. DOI 10.1039/C0SC00331J. PMID 22432049.
- David S. Surry; Stephen L. Buchwald. Biaryl Phosphane Ligands in Palladium-Catalyzed Amination. Angewandte Chemie International Edition. 2008-08-11, s. 6338–6361. ISSN 1521-3773. DOI 10.1002/anie.200800497. PMID 18663711. Bibcode 2012AnChe..51.3695M.
- Ruben Martin; Stephen L. Buchwald. Palladium-Catalyzed Suzuki−Miyaura Cross-Coupling Reactions Employing Dialkylbiaryl Phosphine Ligands. Accounts of Chemical Research. 2008-11-18, s. 1461–1473. ISSN 0001-484. DOI 10.1021/ar800036s. PMID 18620434.
- Steven Kaye; Joseph M. Fox; Frederick A. Hicks; Stephen L. Buchwald. The Use of Catalytic Amounts of CuCl and Other Improvements in the Benzyne Route to Biphenyl-Based Phosphine Ligands. Advanced Synthesis & Catalysis. 2001-12-31, s. 789–794. ISSN 1615-4169. DOI 10.1002/1615-4169(20011231)343:8<789::AID-ADSC789>3.0.CO;2-A.
- Mark R. Biscoe; Brett P. Fors; Stephen L. Buchwald. A New Class of Easily Activated Palladium Precatalysts for Facile C−N Cross-Coupling Reactions and the Low Temperature Oxidative Addition of Aryl Chlorides. Journal of the American Chemical Society. 2008-05-01, s. 6686–6687. DOI 10.1021/ja801137k. PMID 18447360.
- N. C. Bruno; Stephen L. Buchwald. Palladium Precatalysts for Cross-Coupling Reactions. [s.l.]: The Strem Chemiker, 2014. Dostupné online. DOI 10.1021/ja801137k. PMID 18447360. S. 6686–6687.
- Joseph M. Fox; Xiaohua Huang; André Chieffi; Stephen L. Buchwald. Highly Active and Selective Catalysts for the Formation of α-Aryl Ketones. Journal of the American Chemical Society. 2000-02-01, s. 1360–1370. ISSN 0002-7863. DOI 10.1021/ja993912d.
- Wahed A. Moradi; Stephen L. Buchwald. Palladium-Catalyzed α-Arylation of Esters. Journal of the American Chemical Society. 2001, s. 7996–8002. ISSN 0002-7863. DOI 10.1021/ja010797+. PMID 11506555.
- Kelvin L. Billingsley; Timothy E. Barder; Stephen L. Buchwald. Palladium-Catalyzed Borylation of Aryl Chlorides: Scope, Applications, and Computational Studies. Angewandte Chemie International Edition. 2007-07-09, s. 5359–5363. ISSN 1521-3773. DOI 10.1002/anie.200701551. PMID 11506555.
- David W. Old; Michele C. Harris; Stephen L. Buchwald. Efficient Palladium-Catalyzed N-Arylation of Indoles. Organic Letters. 2000-10-01, s. 1403–1406. ISSN 1526-7060. DOI 10.1021/ol005728z.
- John P. Wolfe; Robert A. Singer; Bryant H. Yang; Stephen L. Buchwald. Highly Active Palladium Catalysts for Suzuki Coupling Reactions. Journal of the American Chemical Society. 1999-10-01, s. 9550–9561. ISSN 0002-7063. DOI 10.1021/ja992130h.
- John P. Wolfe; Hiroshi Tomori; Joseph P. Sadighi; Jingjun Yin; Stephen L. Buchwald. Simple, Efficient Catalyst System for the Palladium-Catalyzed Amination of Aryl Chlorides, Bromides, and Triflates. The Journal of Organic Chemistry. 2000-02-01, s. 1158–1174. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo991699y. Bibcode 2007JOCh...72.1134P.
- David S. Surry; Stephen L. Buchwald. Biaryl Phosphane Ligands in Palladium-Catalyzed Amination. Angewandte Chemie International Edition. 2008-08-11, s. 6338–6361. ISSN 1521-3773. DOI 10.1002/anie.200800497. PMID 18663711. Bibcode 2012AnChe..51.3695M.
- Toru Okazawa; Tetsuya Satoh; Masahiro Miura; Masakatsu Nomura. Palladium-Catalyzed Multiple Arylation of Thiophenes. Journal of the American Chemical Society. 2002-05-01, s. 5286–5287. ISSN 0002-7863. DOI 10.1021/ja0259279.
- Joseph M. Fox; Xiaohua Huang; André Chieffi; Stephen L. Buchwald. Highly Active and Selective Catalysts for the Formation of α-Aryl Ketones. Journal of the American Chemical Society. 2000-02-01, s. 1360–1370. ISSN 0002-7863. DOI 10.1021/ja993912d.
- Oliver Thiel; Michal Achmatowicz; Robert Milburn. Process Research and Development for Heterocyclic p38 MAP Kinase Inhibitors. Synlett. 2012-06-11, s. 1564–1574. DOI 10.1055/s-0031-1290425.
- Xiaohua Huang; Kevin W. Anderson; Danilo Zim; Lei Jiang; Artis Klapars; Stephen L. Buchwald. Expanding Pd-Catalyzed C−N Bond-Forming Processes: The First Amidation of Aryl Sulfonates, Aqueous Amination, and Complementarity with Cu-Catalyzed Reactions. Journal of the American Chemical Society. 2003-06-01, s. 6653–6655. ISSN 0002-7863. DOI 10.1021/ja035483w. PMID 12769573.
- Carlos H. Burgos; Timothy E. Barder; Xiaohua Huang; Stephen L. Buchwald. Significantly Improved Method for the Pd-Catalyzed Coupling of Phenols with Aryl Halides: Understanding Ligand Effects. Angewandte Chemie International Edition. 2006-06-26, s. 4321–4326. ISSN 1521-3773. DOI 10.1002/anie.200601253. PMID 16733839. Bibcode 2012AnChe..51.3695M.
- Kevin W. Anderson; Stephen L. Buchwald. General Catalysts for the Suzuki–Miyaura and Sonogashira Coupling Reactions of Aryl Chlorides and for the Coupling of Challenging Substrate Combinations in Water. Angewandte Chemie International Edition. 2005-09-26, s. 6173–6177. ISSN 1521-3773. DOI 10.1002/anie.200502017. PMID 16097019. Bibcode 2012AnChe..51.3695M.
- Shawn D. Walker; Timothy E. Barder; Joseph R. Martinelli; Stephen L. Buchwald. A Rationally Designed Universal Catalyst for Suzuki–Miyaura Coupling Processes. Angewandte Chemie International Edition. 2004-03-26, s. 1871–1876. ISSN 1521-3773. DOI 10.1002/anie.200353615. PMID 15054800. Bibcode 2012AnChe..51.3695M.
- Jacqueline E. Milne; Stephen L. Buchwald. An Extremely Active Catalyst for the Negishi Cross-Coupling Reaction. Journal of the American Chemical Society. 2004-10-01, s. 13028–13032. ISSN 0002-7863. DOI 10.1021/ja0474493. PMID 15469301.
- Eun Jin Cho; Todd D. Senecal; Tom Kinzel; Yong Zhang; Donald A. Watson; Stephen L. Buchwald. The Palladium-Catalyzed Trifluoromethylation of Aryl Chlorides. Science. 2010-06-25, s. 1679–1681. ISSN 0036-8075. DOI 10.1126/science.1190524. PMID 20576888. Bibcode 2010Sci...328.1679C.
- Mark D. Charles; Phillip Schultz; Stephen L. Buchwald. Efficient Pd-Catalyzed Amination of Heteroaryl Halides. Organic Letters. 2005-09-01, s. 3965–3968. ISSN 1523-7060. DOI 10.1021/ol0514754. PMID 16119943.
- Brett P. Fors; Donald A. Watson; Mark R. Biscoe; Stephen L. Buchwald. A Highly Active Catalyst for Pd-Catalyzed Amination Reactions: Cross-Coupling Reactions Using Aryl Mesylates and the Highly Selective Monoarylation of Primary Amines Using Aryl Chlorides. Journal of the American Chemical Society. 2008-10-15, s. 13552–13554. ISSN 0002-7863. DOI 10.1021/ja8055358. PMID 18798626.
- Georgiy Teverovskiy; David S. Surry; Stephen L. Buchwald. Pd-Catalyzed Synthesis of Ar-SCF3 Compounds under Mild Conditions. Angewandte Chemie International Edition. 2011-05-01, s. 7312–7314. ISSN 1521-3773. DOI 10.1002/anie.201102543. PMID 21692157. Bibcode 2012AnChe..51.3695M.
- Brijesh Bhayana; Brett P. Fors; Stephen L. Buchwald. A Versatile Catalyst System for Suzuki−Miyaura Cross-Coupling Reactions of C(sp2)-Tosylates and Mesylates. Organic Letters. 2009-09-03, s. 3954–3957. ISSN 1523-7060. DOI 10.1021/ol9015892. PMID 19663467.
- Donald A. Watson; Mingjuan Su; Georgiy Teverovskiy; Yong Zhang; Jorge García-Fortanet; Tom Kinzel; Stephen L. Buchwald. Formation of ArF from LPdAr(F): Catalytic Conversion of Aryl Triflates to Aryl Fluorides. Science. 2009-09-25, s. 1661–1664. ISSN 0036-8075. DOI 10.1126/science.1178239. PMID 19679769. Bibcode 2009Sci...325.1661W.
- Brett P. Fors; Stephen L. Buchwald. Pd-Catalyzed Conversion of Aryl Chlorides, Triflates, and Nonaflates to Nitroaromatics. Journal of the American Chemical Society. 2009-09-16, s. 12898–12899. ISSN 0002-7863. DOI 10.1021/ja905768k. PMID 19737014.
- Mingjuan Su; Stephen L. Buchwald. A Bulky Biaryl Phosphine Ligand Allows for Palladium-Catalyzed Amidation of Five-Membered Heterocycles as Electrophiles. Angewandte Chemie International Edition. 2012-05-07, s. 4710–4713. ISSN 1521-3773. DOI 10.1002/anie.201201244. PMID 22473747. Bibcode 2012AnChe..51.3695M.
- Chong Han; Stephen L. Buchwald. Negishi Coupling of Secondary Alkylzinc Halides with Aryl Bromides and Chlorides. Journal of the American Chemical Society. 2009-06-10, s. 7532–7533. ISSN 0002-7863. DOI 10.1021/ja902046m. PMID 19441851.
- AlPhos and [(AlPhosPd)2•COD] for Pd-Catalyzed Fluorination [online]. Sigma-Aldrich, 2009-06-10. Dostupné online. DOI 10.1021/ja902046m. PMID 19441851.
- Aaron C. Sather; Hong Geun Lee; Valentina Y. De La Rosa; Yang Yang; Peter Müller; Stephen L. Buchwald. A Fluorinated Ligand Enables Room-Temperature and Regioselective Pd-Catalyzed Fluorination of Aryl Triflates and Bromides. Journal of the American Chemical Society. 2015-10-21, s. 13433–13438. ISSN 0002-7863. DOI 10.1021/jacs.5b09308. PMID 26413908.