Chlorid měďný
Chlorid měďný je anorganická sloučenina se vzorcem CuCl, jeden z chloridů mědi. Jedná se o bílou tuhou látku špatně rozpustnou ve vodě, avšak dobře rozpustnou v koncentrované kyselině chlorovodíkové. Nečisté vzorky jsou nazelenalé díky přítomnosti zeleného chloridu měďnatého.[2]
| Chlorid měďný | |
|---|---|
_chloride.jpg.webp) | |
| Obecné | |
| Systematický název | Chlorid měďný |
| Anglický název | Copper(I) chloride |
| Německý název | Kupfer(I)-chlorid |
| Sumární vzorec | CuCl |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 7758-89-6 |
| Číslo EC (enzymy) | 231-842-9 |
| PubChem | 62652 |
| ChEBI | 53472 |
| Číslo RTECS | GL6990000 |
| Vlastnosti | |
| Molární hmotnost | 98,999 g/mol |
| Teplota tání | 430 °C |
| Teplota varu | 1 212 °C |
| Hustota | 4,139 g/cm3 |
| Dynamický viskozitní koeficient | 2,54 cP (527 °C) 1,92 cP (607 °C) 1,44 cP (697 °C) |
| Index lomu | nD= 1,973 |
| Rozpustnost ve vodě | 1,25 g/100 g (25 °C) |
| Rozpustnost v polárních rozpouštědlech |
kys. chlorovodíková roztoky amonných solí roztoky kyanidů |
| Součin rozpustnosti | 1,86×10−7 |
| Relativní permitivita εr | 10 (20 °C) |
| Měrná magnetická susceptibilita | −5,026×10−6 cm3g−1 |
| Povrchové napětí | 92 mN/m (450 °C) |
| Struktura | |
| Krystalová struktura | krychlová |
| Hrana krystalové mřížky | a=545,7 pm |
| Dipólový moment | 4,27×10−30 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −136,5 kJ/mol |
| Entalpie tání ΔHt | 103,5 J/g |
| Entalpie varu ΔHv | 219,2 J/g |
| Standardní molární entropie S° | 87,1 JK−1 mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −114,06 kJ/mol |
| Izobarické měrné teplo cp | 0,489 9 JK−1 g−1 |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | R22, R50/53 |
| S-věty | (S2), S22, S60, S61 |
| NFPA 704 |  0
3
0
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Vlastnosti
Chlorid měďný je Lewisovou kyselinou, klasifikovanou podle konceptu HSAB jako „měkkou“. Proto má tendenci tvořit stabilní komplexy s měkkými Lewisovými zásadami, například trifenylfosfinem:
- CuCl + P(C6H5)3 → [CuCl(P(C6H5)3)]4
Přestože se CuCl příliš nerozpouští ve vodě, rozpouští se ve vodných roztocích obsahujících vhodné donorové molekuly. Tvoří komplexy s halogenidovými ionty, například s koncentrovanou kyselinou chlorovodíkovou tvoří H3O+ CuCl2−. Podobně tvoří komplexy také s CN−, S2O32− a NH3.
Roztoky CuCl s HCl nebo NH3 pohlcují oxid uhelnatý za vzniku bezbarvých komplexů, například dimeru s chloridovým můstkem [CuCl(CO)]2. Stejný roztok s HCl reaguje také s acetylenem na [CuCl(C2H2)]. Roztok s amoniakem dává s acetylenem výbušný acetylid měďný. Komplexy CuCl s alkeny lze připravit redukcí CuCl2 oxidem siřičitým za přítomnosti alkenu v alkoholovém roztoku. Komplexy s dieny, například 1,5-cyklooktadienem, jsou zvláště stabilní:[3]
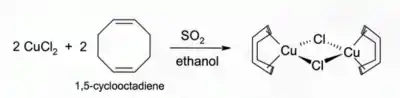
Za nepřítomnosti jiných ligandů jsou vodné roztoky CuCl nestabilní vzhledem k disproporcionaci na měď a chlorid měďnatý.[4] Částečně z tohoto důvodu se CuCl na vzduchu zbarvuje dozelena.
Použití
Hlavním použitím chloridu měďného je jako prekurzor pro výrobu fungicidního oxychloridu měďnatého. Pro tento účel se CuCl generuje synproporcionací a pak se oxiduje vzduchem:
- Cu + CuCl2 → 2 CuCl
- 6 CuCl + 3/2 O2 + 3 H2O → 2 Cu3Cl2(OH)4 + CuCl2
CuCl katalyzuje mnoho organických reakcí. Jeho afinity k oxidu uhelnatému v přítomnosti chloridu hlinitého se využívá v procesu COPureSM.
Organická syntéza
V Sandmeyerově reakci vede působení CuCl na arendiazoniové soli ke vzniku arylchloridů, například:[5]
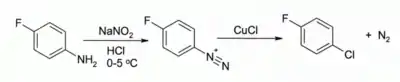
Tato reakce má široký záběr a obvykle nabízí vysokou výtěžnost.
Polymery
CuCl se používá jako katalyzátor v radikálové polymerizaci přenosem atomu (ATRP).
Reference
V tomto článku byl použit překlad textu z článku Copper(I) chloride na anglické Wikipedii.
- Copper(I) chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- United States Patent US4582579 "method of preparing cupric ion free cuprous chloride" Section 2, lines 4-41 , via www.freepatentsonline.com
- Nicholls, D. Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- Greenwood, N.N.; Earnshaw, A. Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- (a) Wade, L. G. Organic Chemistry, 5th ed., p. 871, Prentice Hall, Upper Saddle RIver, New Jersey, 2003. (b) March, J. Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
- Mellor, J. W., A Comprehensive Treatise on Inorganic and Theoretical Chemistry, Volume III, pp157–168. Longmans, Green & Co., London, 1967 (new impression).


chloride_crystal_01.jpg.webp)