Benzoan sodný
Benzoan sodný (natrium-benzoát) je sodná sůl kyseliny benzoové (kyseliny benzenkarboxylové). V potravinářství je známa pod svým E kódem E 211. Dále má také své uplatnění v pyrotechnice.
| Benzoan sodný | |
|---|---|
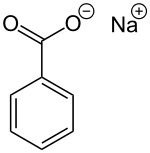
Strukturní vzorec | |
| Obecné | |
| Systematický název | natrium-benzoát |
| Ostatní názvy | Sodná sůl kyseliny benzoové Benzoát sodný Benzenkarboxylát sodný Sodná sůl kyseliny dracylikové Sodná sůl kyseliny fenylkarboxylové[zdroj?] |
| Anglický název | Sodium benzoate |
| Německý název | Natriumbenzoat |
| Funkční vzorec | C6H5COONa |
| Sumární vzorec | C7H5NaO2 |
| Vzhled | Bílá práškovitá látka |
| Identifikace | |
| Registrační číslo CAS | 532-32-1 |
| SMILES | O=C([O-])C1=CC=CC=C1.[Na+] |
| Číslo RTECS | DH6650000 |
| Vlastnosti | |
| Molární hmotnost | 144,11 g/mol |
| Teplota tání | 410–430 °C |
| Teplota varu | rozklad |
| Hustota | 1,44 g/cm3 |
| Disociační konstanta pKa | 9,8 |
| Rozpustnost ve vodě | 66 g/100 ml (20 °C) |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | Žádné nebezpečí |
| S-věty | Žádné nebezpečí |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výskyt
Kyselina benzoová, její soli a estery jsou běžně obsaženy ve většině ovoce, především v bobulovitých plodech. Brusinky jsou velmi bohatým zdrojem benzoové kyseliny. Kromě ovoce se benzoáty přirozeně vyskytují v houbách, skořici, hřebíčku a několika mléčných výrobcích (jako výsledek bakteriálního kvašení). Pro komerční účely je tato látka připravována chemicky z toluenu.
Příprava
Benzoan sodný může být v laboratoři připraven neutralizací kyseliny benzoové hydroxidem sodným. Při této reakci vzniká benzoan sodný a voda.
C6H5COOH + NaOH → C6H5COONa + H2O
Použití
Kyselina benzoová (E210) a benzoáty jsou používány jako konzervační prostředky v kyselých výrobcích proti kvasinkám a plísním. Jsou neúčinné proti bakteriím a v produktech s pH 5 a vyšším (slabě kyselé či neutrální). Vysoké koncentrace způsobují kyselou příchuť, což omezuje jejich použití. Benzoáty jsou často upřednostňovány díky své lepší rozpustnosti.
Dále se také benzoan sodný používá v pyrotechnice jako pohon do pískavých složí, s chloristanem draselným jako oxidačním činidlem, obvykle v poměru 3:7.[2] Po nalisování a zapálení tato směs vydává pískavé zvuky. Nicméně užití této směsi jako raketového paliva má i své stinné stránky, totiž při nesprávném nebo přílišném nalisování může směs způsobit výbuch, jelikož je velmi citlivá na nárazy.
Rovnice spalování benzoanu sodného:
2 C6H5COONa + 15 O2 → 14 CO2 + 4 H2O + 2 NaOH
Nebezpečí
- Denní příjem benzoanu sodného je doporučen do 5 mg/kg tělesné hmotnosti.[zdroj?]
- V používaných koncentracích nemá žádné vedlejší účinky. U některých lidí mohou kyselina benzoová a benzoáty uvolňovat histamin a způsobovat pseudoalergické reakce.
- V kombinaci s vitamínem C (neboli E300) se tvoří benzen, který je silný Karcinogen.
- Může poškozovat strukturu DNA působí jako Teratogen
- Může vyvolávat dědičné choroby jako je Parkinsonova nemoc.
- Z těchto i dalších důvodů je v některých státech použití benzoanu sodného omezeno jen na úzký okruh potravin: Nealkoholické nápoje, sirup, sojová omáčka (max 0,6g/kg), margarín (max. 1g/kg), kaviár (max 2,5g/kg).
- V ČR se benzoan sodný neboli E211 používá široce. Je v českých džusech, českých salátech s majonézou, v českých nakládaných okurkách a mnoha výrobcích made in ČR. Dříve se prodával jako bílý prášek v sáčku pod názvem "PETOL" jako konzervační prostředek pro domácnost - působí bakteriostaticky a fungistaticky. V ovocných zavařeninách a kompotech se měnil na benzen (díky vitamínu C), navíc byla často překročena jeho maximální dávka (0,1% váhy potraviny). Jeho výroba byla zakázána.
- Celosvětová výroba benzoanu sodného se odhaduje na 60 000 tun ročně. WHO varuje před zatížením životního prostředí tímto jedem
Odkazy
Reference
- Sodium benzoate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- VÁLEK, Leo. Pyrotechnika tajemství zbavená: odpalte si svůj vlastní ohňostroj. 1. vyd. [s.l.]: [s.n.], 2009. 128 s. ISBN 978-80-254-6106-8. S. 64.
