Barevnost komplexů
Látka je obecně barevná, pokud je schopna své vnitřní energetické přechody, vyžadující jisté množství energie, vyzářit v podobě viditelného světla. Energie potřebná k energetickému přechodu může být například dodána v podobě kvanta viditelného světla.
Princip vzniku barvy
Energie světelného kvanta E je dána rovnicí :
- E = hν nebo E = hc/λ
kde h je Planckova konstanta, ν frekvence, c rychlost světla a λ vlnová délka.
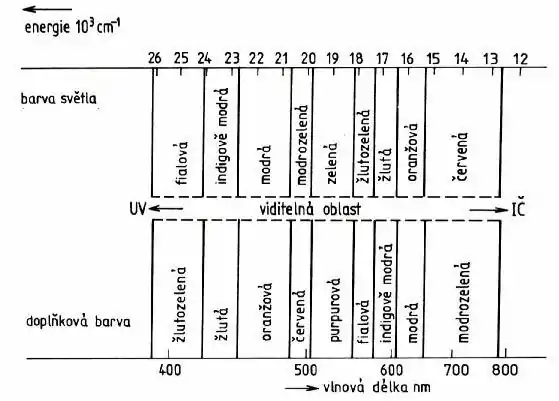
Pokud je látka schopna absorbovat určitou oblast vlnových délek viditelného světla (určitou „barvu“), pak se na bílém světle jeví zbarvena tzv. doplňkovou (komplementární) barvou, v jejímž spektru absorbované vlnové délky chybí. Doplňková barva se určuje pomocí diagramu chromaticity (na obrázku). Doplňková barva (námi viditelná) je naproti barvě pohlcené. Barevné komplexní sloučeniny tedy musí absorbovat vlnové délky viditelného světla, tedy v rozsahu asi 380 – 770 nm. Energie tohoto záření ovšem nepostačuje na přechod elektronu do orbitalu s vyšším kvantovým číslem (např. 3d → 4p), proto je nutné předpokládat méně energeticky náročné elektronové přechody. Ukázalo se (zjednodušeně řečeno), že takovými vhodnými přechody mohou být tzv. d-d přechody elektronů mezi různými energetickými hladinami rozštěpených d-orbitalů, které zavedla teorie krystalového pole.
Určení elektronových přechodů
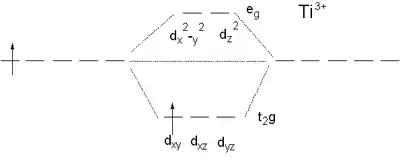
Nejjednodušším případem pro určení elektronových přechodů je titanitý kationt Ti3+ s konfigurací d1 (má pouze jeden elektron v d-orbitalech), jehož vodné roztoky mají červenofialové zabarvení. Z diagramu chromaticity je patrné, že tato barva vzniká adsorpcí zelené části spektra. V roztoku vytváří titanitý kationt komplexní částici [Ti(H2O)6]3+, která má oktaedrické uspořádání. Adsorpci světla při přibližně 500 nm (20 000 cm−1) lze připsat jedinému d-elektronu v d-orbitalech, který přejde z energeticky nižšího orbitalu t2g do orbitalu eg. Po dosazení údajů do rovnice Δ0 = hcNA/λ (h = 6,626×10−37 kJ; c = 2,998×108 m/s; Avogadrova konstanta NA=6,022×1023 1/mol; λ = 500×109 m) vyjde energie Δ0 = 239 kJ/mol. Tato energie je velmi blízká vazebné energii v molekule Cl2, která má hodnotu 242 kJ/mol.
Toto byl nejjednodušší případ elektronového přechodu. Velmi podobná je konfigurace d9, na kterou se pohlíží jako na konfiguraci d10 s jedním chybějícím elektronem. Konfigurace d2 až d8 nejsou tak jednoduché. Interpretace adsorpčních spekter jejich komplexů pomocí teorie krystalového pole předpokládá znalost způsobů štěpení spektroskopických termů centrálního atomu elektrostatickým polem.
Co dále přispívá ke vzniku barvy
Existuje relativně jednoduchá souvislost mezi vlnovou délkou nebo energií absorbovaného záření a silou ligandového pole komplexů – tedy energetickým rozdílem mezi rozštěpenými d-orbitaly. Čím vyšší síla ligandového pole, tím vyšší energii vyžaduje přeskok elektronu a tím kratší vlnovou délku světla komplex absorbuje. Změna zbarvení komplexu vlivem různých ligandů je základem dříve zmíněné spektrochemické řady (neboli Fajansova-Tsuchidova řada), kde jsou ligandy seřazeny v podstatě podle klesající vlnové délky světla absorbovaného příslušnými komplexy.
Barva komplexu není dána pouze absorbováním záření při d-d přechodech elektronů centrálního atomu. Energii viditelného záření mohou odpovídat i přechody elektronů centrálního atomu do prázdných orbitalů ligandu nebo naopak (absorpční pásy přenosu náboje, tzv. CT-přechody „charge transfer“).
Související články
Literatura
- Dr. Heinrich Remy, Anorganická chemie 2. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 2. díl, 1. vydání 1993 ISBN 80-85427-38-9
- Jursík F.: Anorganická chemie kovů. 1. vyd. 2002. ISBN 80-7080-504-8 (elektronická verze)