Azido-alkynová Huisgenova cykloadice
Azido-alkynová Huisgenova cykloadice je 1,3-dipolární cykloadiční reakce azidu s koncovým nebo vnitřním alkynem za vzniku 1,2,3-triazolu. Jako první ji popsal německý chemik Rolf Huisgen (1920–2020).[1]
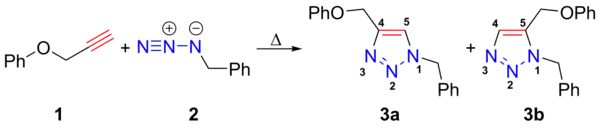
Ve výše zobrazené reakci[2] azid 2 reakuje s alkynem 1, přičemž se vytváří triazol jako kombinace 1,4-adduktu (3a) a 1,5-adduktu (3b); reakce probíhá při teplotě 98 °C po dobu 18 hodin.
Klasická 1,3-cykloadice, tedy reakce azidového 1,3-dipólu s alkenem jako dipolarofilem se používá málokdy kvůli nízké reaktivitě způsobené nízkou elektronovou hustotou na alkenu a eliminačními vedlejšími reakcemi. Jistého úspěchu bylo dosaženo s využitím nekovově katalyzovaných cykloadicí, jako jsou například reakce s využitím dipolarofilů, které patří mezi alkany s nízkou elektronovou hustotou[3] nebo alkynů.
I když azidy nejsou nejreaktivnějšími dostupnými 1,3-dipóly, tak se upřednostňují, protože se při jejich použití objevuje jen málo vedlejších reakcí a protože jsou při běžně využívaných reakčních podmínkách stabilní.
Katalýza měďnými sloučeninami
Katalyzátory
Vylepšení azido-alkynové cykloadice využitím měďnatých katalyzátorů a provedením reakce za jen mírně zvýšených teplot představil Rolf Huisgen v 70. letech 20. století.[4] Původní reakce probíhala příliš pomalu.
Reakce funguje při použití koncových alkynů. Sloučenina mědi projde reakcí, při níž se kov připojí na molekulu alkynu. Měďnatou sloučeninu lze dodat jako předem vytvořený komplex, je ji možné vytvořit přímo v reakční směsi jedním z následujících způsobů:
- Do reakční směsi se přidá měďnatá sloučenina za přítomnosti redukčního činidla (například askorbanu sodného), které zredukuje měďnatou sloučeninu na měďnou. Výhoda tohoto postupu spočívá v odstranění nutnosti použít zásadu. Přítomnost redukčního činidla také deaktivuje každý atom kyslíku, který se do soustavy dostane a zpětnou oxidací Cu+ na Cu2+ by snížil výtěžnost reakce. K nejčastěji používaným sloučeninám patří CuSO4.
- Oxidací kovové mědi
- Pokud by rozpouštění sloučeniny bylo problémem, lze použít měďnaté halogenidy; jodid a bromid ovšem vyžadují přítomnost aminů nebo vyšší teplotu.
Jako rozpouštědla se běžně používají polární aprotické látky jako například tetrahydrofuran (THF), dimethylsulfoxid (DMSO), acetonitril, dimethylformamid (DMF), ale i nepolární látky jako toluen. Lze použít i směs několika rozpouštědel.
Nejčastěji používanými zásadami jsou N,N-diisopropylethylamin a triethylamin (Et3N).[5]
Mechanismus
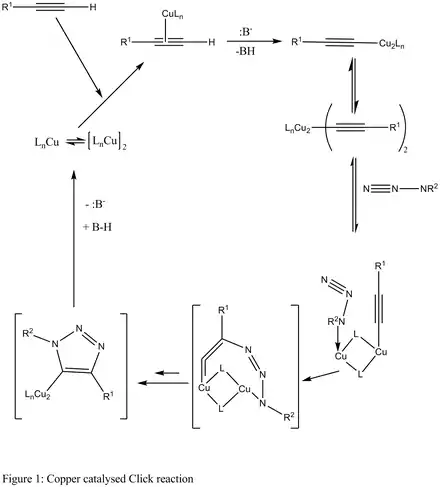
Mechanismus azido-alkynové Huisgenovy cykloadice byl navržen na základě funkční teorie hustoty.[6] In situ vytvořené měďné sloučeniny vytváří s trojnou vazbou koncového alkynu π komplex. Za přítomnosti zásady se díky tomu, že je nejkyselejší, deprotonuje koncový vodík za vzniku acetylidu mědi jako meziproduktu, předpokládá se, že meziprodukt obsahuje sva atomy mědi.[7][8][9][10][11][12] Jeden atom mědi je navázán na acetylid, zatímco druhý slouží k jeho aktivaci. Kovové centrum se koordinuje s elektron dusíkového atomu, azid a acetylid nejsou tedy koordinovány na stejný atom.
Vliv ligandů
Použité ligandy jsou nestabilní a koordinují se jen slabě. Azid nahradí jeden z ligandů za vzniku komplexu měď-azid-acetylid a zde dochází k cyklizaci, po níž následuje protonace; zdrojem protonu je vodík odštěpený z koncového alkynu pomocí zásady. Následně disociací vzniká konečný produkt a katalyzátor se obnovuje a lze jej tedy využít v dalším reakčním cyklu.
Při nekatalyzované reakci by alkyn zůstal slabým elektrofilem a velká energetická bariéra by vedla ke snížení rychlosti reakce.
Katalýza sloučeninami ruthenia
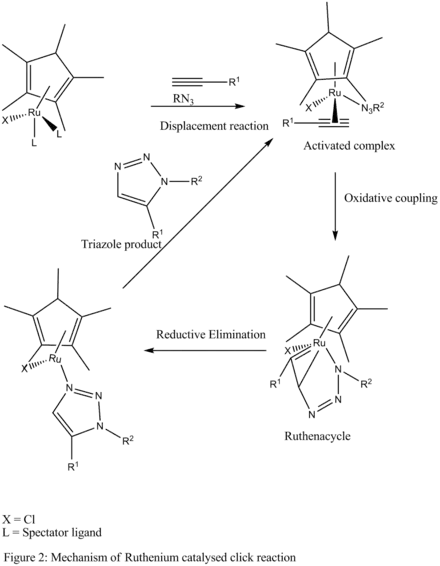
Při 1,3-dipolárních azido-alkynových cykloadicích (RuAAC) vznikají 1,5-triazoly. Na rozdíl od katalýzy měďnými sloučeninami (CuAAC), při kterých reagují pouze koncové alkyny, zde mohou do reakce vstoupit jako koncové, tak i vnitřní alkyny. Během katalytického cyklu tak nevznikají acetylidy ruthenia.
Podle předpokládaného mechanismu nejprve z výchozího ligandu vzniká aktivovaný komplex, který se následně oxidačním párováním alkynu a azidu přemění na sloučeninu obsahující ruthenium v cyklickém řetězci. Nová vazba mezi uhlíkem a dusíkem se vytvoří mezi elektronegativnějším a stericky méně zatíženým uhlíkem alkynu a koncovým dusíkem azidu. Metalocyklický meziprodukt následně projde redukční eliminací za vzniku aromatického triazolu a obnovení katalyzátoru nebo aktivovaného komplexu a jejich uvolnění pro další reakční cykly.
Jako katalyzátory se zde nejčastěji používají Cp*RuCl(PPh3)2, Cp*Ru(COD) a Cp*[RuCl4]. Katalyzátory obsahující cklopentadienylovou (Cp) skupinu. Lepších výsledků bývá ovšem dosahováno s pentamethylcyklopentadienyl(Cp*) sloučeninami, což může být způsobeno stericky zatíženými skupinami Cp*, jež usnadňuje odstranění výchozího ligandu.[14][15]
Katalýza sloučeninami stříbra
Jsou známy azido-alkynové cykloadiční reakce katalyzované stříbrnými sloučeninami, při nichž vznikaly 1,4-triazoly. Mechanismus je obdobný jako při katalýze měďnými sloučeninami. Samotné stříbrné soli nejsou pro katalyzování cykloadice vhodné, jako zdroj stříbrných iontů se tak používají jejich komplexy.[16][17]
Předem připravené stříbrné acetylidy kupodivu samotné nereagují s azidy; reagují ale za přítomnosti měďnatých sloučenin.[18]
Reference
V tomto článku byl použit překlad textu z článku Azide-alkyne Huisgen cycloaddition na anglické Wikipedii.
- Huisgen, R. Centenary Lecture - 1,3-Dipolar Cycloadditions. Proceedings of the Chemical Society of London. 1961, s. 357. DOI 10.1039/PS9610000357. (anglicky)
- Development and Applications of Click Chemistry Gregory C. Patton November 8, 2004 http://www.scs.uiuc.edu Online[nedostupný zdroj]
- David Amantini; YES; ORIANA PIERMATTI; FERDINANDO PIZZO; ENNIO ZUNINO; LUIGI VACCARO. Synthesis of 4-Aryl-1H-1,2,3-triazoles through TBAF-Catalyzed [3 + 2] Cycloaddition of 2-Aryl-1-nitroethenes with TMSN3 under Solvent-Free Conditions. The Journal of Organic Chemistry. 2005, s. 6526–6529. DOI 10.1021/jo0507845. (anglicky)
- 1,3-Dipolar Cycloaddition Chemistry, published by Wiley and updated in 2002
- Morten Meldal; YES. Cu-Catalyzed Azide-Alkyne Cycloaddition. Chemical Reviews. 2008, s. 2952–3015. DOI 10.1021/cr0783479. PMID 18698735. (anglicky)
- F Himo; T LOVELL; R HILGRAF; VV ROSTOVTSEV; L NOODLEMAN; KB SHARPLESS; VV FOKIN. Copper(I)-Catalyzed Synthesis of Azoles, DFT Study Predicts Unprecedented Reactivity and Intermediates. Journal of the American Chemical Society. 2005, s. 210–216. DOI 10.1021/ja0471525. (anglicky)
- RODIONOV, Valentin O.; FOKIN, Valery V.; FINN, M. G. Mechanism of the Ligand-Free CuI-Catalyzed Azide–Alkyne Cycloaddition Reaction. Angewandte Chemie International Edition. 2005-04-08, s. 2210–2215. Dostupné online. ISSN 1521-3773. DOI 10.1002/anie.200461496. (anglicky)
- WORRELL, B. T.; MALIK, J. A.; FOKIN, V. V. Direct Evidence of a Dinuclear Copper Intermediate in Cu(I)-Catalyzed Azide-Alkyne Cycloadditions. Science. 2013-04-26, s. 457–460. Dostupné online. ISSN 0036-8075. DOI 10.1126/science.1229506. PMID 23558174. Bibcode 2013Sci...340..457W. (anglicky)
- IACOBUCCI, Claudio; REALE, Samantha; GAL, Jean-François; DE ANGELIS, Francesco. Dinuclear Copper Intermediates in Copper(I)-Catalyzed Azide–Alkyne Cycloaddition Directly Observed by Electrospray Ionization Mass Spectrometry. Angewandte Chemie International Edition. 2015-03-02, s. 3065–3068. Dostupné online. ISSN 1521-3773. DOI 10.1002/anie.201410301. (anglicky)
- JIN, Liqun; TOLENTINO, Daniel R.; MELAIMI, Mohand; BERTRAND, Guy. Isolation of bis(copper) key intermediates in Cu-catalyzed azide-alkyne "click reaction". Science Advances. 2015-06-01, s. e1500304. Dostupné online. ISSN 2375-2548. DOI 10.1126/sciadv.1500304. PMID 26601202. Bibcode 2015SciA....1E0304J. (anglicky)
- ÖZKILIÇ, Yılmaz; TÜZÜN, Nurcan Ş. A DFT Study on the Binuclear CuAAC Reaction: Mechanism in Light of New Experiments. Organometallics. 2016-08-22, s. 2589–2599. Dostupné online. ISSN 0276-7333. DOI 10.1021/acs.organomet.6b00279. (anglicky)
- ZIEGLER, Micah S.; LAKSHMI, K. V.; TILLEY, T. Don. Dicopper Cu(I)Cu(I) and Cu(I)Cu(II) Complexes in Copper-Catalyzed Azide–Alkyne Cycloaddition. Journal of the American Chemical Society. 2017-04-19, s. 5378–5386. Dostupné online. ISSN 0002-7863. DOI 10.1021/jacs.6b13261. (anglicky)
- V. D. Bock; H. HIEMSTRA; J. H. VAN MAARSEVEEN. CuI-Catalyzed Alkyne–Azide "Click" Cycloadditions from a Mechanistic and Synthetic Perspective. European Journal of Organic Chemistry. 2006, s. 51–68. DOI 10.1002/ejoc.200500483. (anglicky)
- Li Zhang, Xinguo Chen, Peng Xue, Herman H. Y. Sun, Ian D. Williams, K. Barry Sharpless, Valery V. Fokin, and Guochen Jia;; YES. Ruthenium-Catalyzed Cycloaddition of Alkynes and Organic Azides. Journal of the American Chemical Society. 2005, s. 15998–15999. DOI 10.1021/ja054114s. PMID 16287266. (anglicky)
- Brant C. Boren; SRIDHAR NARAYAN; LARS K. RASMUSSEN; LI ZHANG; HAITAO ZHAO; ZHENYANG LIN; GUOCHEN JIA. Ruthenium-Catalyzed Azide−Alkyne Cycloaddition: Scope and Mechanism. Journal of the American Chemical Society. 2008, s. 8923–8930. DOI 10.1021/ja0749993. PMID 18570425. (anglicky)
- McNulty, J.; KESKAR, K; VEMULA, R. The First Well-Defined Silver(I)-Complex-Catalyzed Cycloaddition of Azides onto Terminal Alkynes at Room Temperature. Chemistry: A European Journal. 2011, s. 14727–14730. DOI 10.1002/chem.201103244. PMID 22125272. (anglicky)
- McNulty, J.; KESKAR, K. Discovery of a Robust and Efficient Homogeneous Silver(I) Catalyst for the Cycloaddition of Azides onto Terminal Alkynes. Eur. J. Org. Chem.. 2012, s. 5462–5470. DOI 10.1002/ejoc.201200930. (anglicky)
- Proietti Silvestri, I., Andemarian, F., Khairallah, G.N., Yap, S., Quach, T., Tsegay, S., Williams, C.M., O'Hair, R.A.J., Donnelly, P.S., Williams, S.J. Copper(i)-catalyzed cycloaddition of silver acetylides and azides: Incorporation of volatile acetylenes into the triazole core. Organic and Biomolecular Chemistry. 2011, s. 6082–6088. DOI 10.1039/c1ob05360d. PMID 21748192. (anglicky)