Antikoagulans
Antikoagulancia (sg. antikoagulans či antikoagulant) jsou léčiva snižující srážlivost krve (hemokoagulace). Svým působením blokují koagulační faktory, a tím i vlastní koagulaci (laicky se hovoří o „ředění krve“, což je zcela nesprávné, protože po podání antikoagulancií není krev ani řidší, ani hustší). Používají se především k profylaxi žilní a nitrosrdeční trombózy a následné embolie. Laboratorně se využívají jako protisrážlivá činidla.
K vyšetření schopnosti srážení krve slouží především INR (Quickův test) či aPTT.
Klasifikace
Antikoagulancia lze rozdělit na látky používané in vivo (pacient) a látky používané in vitro (laboratoř):
- in vivo: heparin a jeho deriváty, warfarin, hirudin
- in vitro: heparin, oxalát sodný, citrát sodný, EDTA
Dále lze antikoagulancia rozdělit podle jejich mechanismu účinku na přímá a nepřímá. Přímá inaktivují samotné koagulační faktory přítomné v plazmě, zatímco nepřímá ovlivňují koagulační faktory snížením jejich tvorby v játrech.
| Přímá antikoagulancia | Nepřímá antikoagulancia | |
|---|---|---|
| Přímé inhibitory trombinu / faktoru Xa | Nepřímé inhibitory trombinu / faktoru Xa | |
|
|
|
Přímá antikoagulancia
Přímá antikoangulancia blokují především trombin a/nebo faktor Xa. Trombin je klíčový protein koagulační kaskády, který aktivuje řadu koagulačních faktorů, a zejména katalyzuje přeměnu fibrinogenu na nerozpustný fibrin.
- Nepřímé inhibitory trombinu / faktoru Xa působí prostřednictvím aktivace přirozeného inhibitoru trombinu – antitrombinu (AT III). Jsou tudíž závislé na přítomnosti endogenních inhibitorů. Tak fungují např. hepariny.
- Přímé inhibitory trombinu / faktoru Xa se váží na trombin nebo faktor Xa a tím blokují jejich funkci. Patří k nim gatrany a hirudiny.
Heparin a jeho deriváty
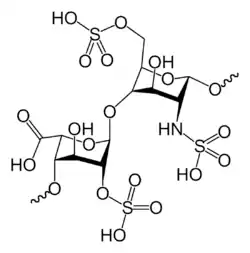
Heparin je směs kyselých mukopolysacharidů, běžně se vyskytujících v organismu. Terapeuticky se využívá heparin nefrakcionovaný, nízkomolekulární a pentasacharidy.
Nefrakcionovaný heparin
Nefrakcionovaný (přirozený) heparin aktivuje AT III, který ireverzibilně inaktivuje trombin a některé další koagulační faktory (např. faktor Xa). Má následující vlastnosti:
- neprochází placentou, a proto je vhodný pro použití v těhotenství;
- má specifické antidotum – protamin;
- špatně se vstřebává, podává se nitrožilně (při s. c. aplikaci nastupuje účinek cca po 2 hodinách);[1]
- působí krátkodobě a má variabilní biodegradaci, proto je třeba pravidelně po 6 hodinách kontrolovat APTT;
- může navodit trombocytopenii
Jeho nežádoucími účinky je krvácení, alergická reakce, osteoporóza (při dlouhodobém užívání).
Nízkomolekulární hepariny
Nízkomolekulární hepariny (anglicky: low molecular weight heparin, odtud zkratka LMWH) mají kratší řetězce vzniklé rozštěpením heparinu. Působí podobně jako nefrakcionovaný heparin (inaktivují však především faktor Xa), ale jsou bezpečnější, mají lepší antikoagulační účinek, méně nežádoucích účinků a výhodnější farmakokinetiku. Nízkomolekulární hepariny:
- se lépe vstřebávají, aplikují se s. c. (většinou do břicha);
- mají delší účinek;
- mají nižší riziko indukované trombocytopenie;
- nemusí se kontrolovat APTT;
- jsou omezeně neutralizovatelné protaminem.
V praxi se používá zejména enoxaparin.
Pentasacharidy
Pentasacharidy jsou synteticky připravené řetězce pěti sacharidových jednotek, odvozené od heparinu. Prostřednictvím AT III inaktivují faktor Xa. Pentasacharidy:
- mají širší terapeutické okno – jsou bezpečnější a mají jednoduché dávkování;
- mají dlouhý a předvídatelný efekt;
- jsou nákladné (cca 2× dražší proti nízkomolekulárním heparinům);
- nemají specifické antidotum.
Příkladem používané látky je fondaparinux, idraparinux'je ve vývoji.
Hirudiny
Hirudin je přírodní antikoagulační peptid produkovaný pijavicemi (Hirudo medicinalis). Má dobré vlastnosti, ale je drahý a v ČR se nepoužívá. V současné době několik výrobců dodává rekombinantně vyrobené deriváty hirudinu, které na rozdíl od přirozeně se vyskytujícího peptidu postrádají sulfátovou skupinu – desirudin[2]
Gatrany
Gatrany přímo inhibují trombin. Podává se ústně (p. o.), má rychlý nástup účinku a dlouhodobé působení. Dá se použít v profylaxi tromboembolické nemoci (srovnatelný s enoxaparinem) a fibrilace síní (lepší než warfarin), používá se však především v ortopedických indikacích.
Xabany
Xabany přímo inhibují faktor Xa. Podává se ústně, je předvídatelný, očekává se jeho indikace při léčbě fibrilace síní.
Nepřímá antikoagulancia
Nepřímá antikoagulancia jsou kompetitivní antagonisté vitaminu K (mají podobnou strukturu). Výsledkem jejich působení je snížení tvorby vitamin K-dependentních koagulačních faktorů.
Redukovaný vitamin K je oxidován během syntézy faktorů II, VII, IX, X a antikoagulačních proteinů C a S. Oxidovanou formu pak musí zregenerovat vitamin K reduktáza – enzym, jenž je cílovou strukturou, kterou nepřímá antikoagulancia blokují. Z výše uvedeného je zřejmé, že tyto látky jsou účinné výhradně in vivo. Vrchol antikoagulačního účinku nastupuje asi za 3 dny.
Účinnost antikoagulační terapie může být ovlivněna množstvím vitaminu K v potravě nebo jeho vstřebáváním. Mimo potravinových interakcí existuje i celá řada interakcích lékových, založených na ovlivnění biotransformace léčiva, syntézy a degradace koagulačních faktorů nebo vytěsnění léčiva z vazby na albumin.
Nežádoucím účinkem nepřímých antikoagulancií je krvácení. Objeví-li se, je třeba lék vysadit; je možné podat vitamin K, plazmu nebo koncentrát koagulačních faktorů.
Warfarin
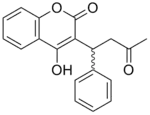
Warfarin je kumarinový derivát. Byl dlouhou dobu víceméně jediným použitelným perorálním antikoagulanciem. Zpočátku se používal jako jed na krysy, ale možnosti jeho potenciálního využití odhalil sebevražedný pokus, jenž byl následován poruchou krevní srážlivosti.
Objev warfarinu
Počátek objevu warfarinu spadá do 20. let 20. století do oblasti prerií Severní Ameriky a Kanady. Dobytek, který se zde pásl začal umírat bez zjevné příčiny na vnitřní krvácení. Bylo vypozorováno, že ke krvácení docházelo nejčastěji pokud bylo vlhké klima a sladké jetelové seno(Melilotus alba a Melilotus officinalis) bylo napadeno plísní. Toto onemocnění bývalo označeno jako „nemoc sladkého jetele“.
Možná léčba, se kterou přišli veterináři Frank W. Schofield a Lee M. Roderick spočívající buď v odstranění plesnivého sena nebo podání krevní transfuze nebyla farmářům známa nebo jimi přijata(mj. i pro náklady na nové seno v době finanční krize). Farmář z Wisconsinu Ed Carlson jednoho dne zavezl mrtvou krávu s nádobou nesražené krve do experimentální stanice, kde pracoval Karl Link. Ten se spolu se svým týmem pustil do identifikace a separace látky, která způsobovala toto hemoragické onemocnění. Roku 1940 Link a jeho kolegové zjistili, že onou látkou je methylenbishydroxykumarin, který je známější pod názvem dikumarol. Ten si roku 1941 patentovala agentura Wisconsin Alumni Research Foundation (WARF), která výzkum financovala.[3]
Link zvažoval použití dikumarolu jako jedu, ten však působil příliš pomalu. Link tedy spolu s týmem navrhl 150 variant jedu a z ní byla vybrána varianta 42 jako zvláště účinná. Získala název warfarin podle finanční agentury a roku 1948 byla uvedena pod názvem rodenticid.
Roku 1951 se příslušník armády USA pokusil o sebevraždu několika dávkami warfarinu (rodenticidu), po léčbě pomocí vitamínu K se pacient zotavil. Následně začaly studie o použití warfarinu jako antikoagulantu. Warfarin přešel do klinického použití a pod obchodním názvem Coumadin roku 1954 byl schválen pro použití u lidí.
Na vzdor širokému použití nebyl mechanismus účinku warfarinu objeven až do roku 1978.
Mezi první příjemce Warfarinu patřil prezident Dwight D. Eisenhower, který jej dostal roku 1955 po infarktu myokardu.[3]
Variabilita
Ve farmakokinetice warfarinu jsou velké interindividuální rozdíly, proto je třeba dávku přísně individualizovat. Uplatňuje se polymorfismus vitamin K reduktázy a systému CYP2C9. Interagují léčiva (zejména amiodaron, fluvastatin, klopidogrel, nesteroidní antirevmatika, atd) a potraviny s obsahem vitaminu K (listová zelenina, maso dobytka přikrmovaného vitaminem K). V dietě by proto mělo být zastoupení těchto potravin pokud možno konstantní.
Vedení léčby
Na začátku léčby dochází ke krátkodobému prokoagulačnímu účinku warfarinu, protože se poněkud sníží syntéza proteinu C a S. Tuto periodu je proto třeba krýt aplikací nízkomolekulárního heparinu. Začíná se dávkou 5 mg/den (s překrytím LMWH). Dávkování se pak upravuje dle výsledků INR (Quick).
Jak již bylo řečeno, účinek warfarinu kolísá. Proto je nutné pravidelně kontrolovat INR, které by se mělo pohybovat v rozmezí 2–3,5. Měření by se mělo provádět jednou za 3–5 dní, u stabilních pacientů (tj. 2× po sobě v normě) jednou za 4 týdny. Aktuálním trendem je domácí monitorování jednou týdně.
Indikací pro podání warfarinu je profylaxe trombózy a embolie u fibrilace síní, stav po implantaci mechanických chlopenních protéz a u flebotrombózy. Naproti tomu kontraindikací jsou krvácivé stavy, těhotenství (při dávkách nad 5 mg/den převedení na LMWH).
Při krvácení je nutné přerušit léčbu, případně podat čerstvou mraženou plazmu, vitamin K či komplex koagulačních faktorů.
Reference
- V tomto článku je použit text článku Antikoagulancia ve WikiSkriptech českých a slovenských lékařských fakult zapojených v MEFANETu.
- LINCOVÁ, Dagmar; FARGHALI, Hassan a kolektiv. Základní a aplikovaná farmakologie. 2.. vyd. Praha: Galén, 2007. 672 s. ISBN 978-80-7262-373-0. S. 272–277.
- MAREK, Josef a kolektiv. Farmakoterapie vnitřních nemocí. 3.. vyd. Praha: Grada Publishing, 2005. 773 s. ISBN 80-247-0839-6. S. 302–303. Autor kapitoly: Jan Kvasnička.
- LIM, Gregory B. Warfarin: from rat poison to clinical use [online]. Nature Reviews Cardiology, 2017-12-14 [cit. 2021-12-07]. Dostupné online. (angličtina)
Externí odkazy
 Obrázky, zvuky či videa k tématu antikoagulans na Wikimedia Commons
Obrázky, zvuky či videa k tématu antikoagulans na Wikimedia Commons