Vitamín K
Vitamín K je vitamín rozpustný v tucích. Označení „K“ je odvozeno z německého slova „Koagulation“, tedy od procesu srážení krve. Vitamín K je nezbytný pro funkci několika proteinů podílejících se na srážení krve.[1] Vitamín K je dále nezbytný v procesu mineralizace kostí, buněčného růstu a metabolismu proteinů cévní stěny.[2]
| Vitamín K | |
|---|---|
| Obecné | |
| Systematický název | |
| Identifikace | |
| Registrační číslo CAS | 12001-79-5 |
| Vlastnosti | |
| Molární hmotnost | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
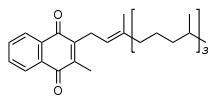

Názvosloví a chemická stavba
Existují dvě přirozeně se vyskytující formy vitamínu K. Vitamín K1, fylochinon, je syntetizován rostlinami. Vitamín K2, menachinon, je produkován bakteriemi. Vitamín K2 se dále dělí podle počtu opakujících se izoprenových jednotek v bočním řetězci molekuly. Pro podtypy vitamínu K2 používáme zkratku MK a přidáváme specifikaci číslem n (MK-n), kde n označuje počet izoprenových jednotek. Běžné jsou podtypy MK-4, MK-7, MK-8, MK-9. Lidský organizmus, resp. bakterie přítomné v lidském organizmu, vytvářejí MK-4. MK-4 ale není bakteriemi vyráběn v těle v dostatečném množství.[2] Existuje ještě syntetický vitamín K3, menadion, přidávaný do zvířecích krmiv, z něhož se v organizmu vytváří K2 ve formě MK-4. Menadion je v ČR zakázáno podávat lidem. Ukazuje se, že K1 a K2 jsou v organizmu využívány rozdílným způsobem. Zatímco K1 je využíván především pro srážení krve a jeho hlavním orgánem působení jsou játra, K2 hraje důležitou úlohu v nekoagulačních dějích, a to v metabolismu a mineralizaci kostí, v buněčném růstu a v metabolismu buněk cévní stěny. Vitamín K2 (ve formě MK-4) se vyskytuje především v jiných orgánech, než v játrech, a to ve vyšších koncentracích než fylochinon.[3] Tato skutečnost, spolu s existencí unikátní cesty jeho syntézy, svědčí o tom, že K2 má jedinečnou biologickou funkci, která dosud nebyla popisována.[4]
Funkce
Vitamín K funguje jako kofaktor proenzym, který katalyzuje karboxylaci kyseliny glutamové na gama-karboxyglutamovou (GLA). Přestože se vitamín K dependentní gama-karboxylace vyskytuje pouze u specifických reziduí kyseliny glutamové, je nezbytná k tomu, aby tato rezidua správně vázala vápník.[5][6]
Hemokoagulace (srážení krve)
Schopnost vázat vápenaté ionty (Ca2+) je nutná pro aktivaci sedmi vitamín K dependentních faktorů srážlivosti (proteinů) v koagulační kaskádě. Pojem koagulační kaskáda znamená řadu akcí, z nichž každá je závislá na předcházející, a způsobuje zastavení krvácení tím, že vytvoří sraženinu. Vitamín K dependentní gama-karboxylace reziduí kyseliny glutamové umožňuje proteinům vázat vápník. Faktory II (protrombin), VII, IX a X tvoří základ koagulační kaskády. Protein Z zvyšuje účinek trombinu (aktivované formě protrombinu) tím, že podporuje jeho spojení s fosfolipidy v buněčných membránách. Proteiny C a S jsou antikoagulační bílkoviny, které zajišťují kontrolu a rovnováhu v koagulační kaskádě. Protein Z má rovněž antikoagulační funkci. Vitamín K dependentní koagulační faktory jsou syntetizovány v játrech. Závažná onemocnění jater vedou ke snížení hladiny vitamín K dependentních koagulačních faktorů a zvýšenému riziku nekontrolovaného krvácení (hemoragie).[7]
Někteří lidé mají vyšší riziko tvorby sraženin, které mohou blokovat průtok krve v tepnách na srdci, mozku nebo plicích, což může vést k infarktu, mozkové mrtvici nebo plicní embolii. Proto byla vyvinuta perorální antikoagulancia (léky snižující krevní srážlivost), např. warfarin. Warfarin brání regeneraci vitamínu K a vytváří jeho nedostatek.
Ačkoliv je vitamín K rozpustný v tucích, v organizmu je uchováván jen v malém množství. Bez pravidelného denního příjmu je jeho zásoba rychle vyčerpána. Možná kvůli své omezené schopnosti uchovávat větší množství vitamínu K, jej tělo dokáže recyklovat v tzv. cyklu vitamínu K. Regenerační cyklus vitamínu K je narušen až zastaven působením perorálních antikoagulancií. Vzniká nedostatek vitamínu K a tím nedostatečná karboxylace (aktivace) vitamín K dependentních koagulačních proteinů. Koagulační faktory nejsou dostatečně aktivovány a tím se brzdí tvorba krevní sraženiny. Vysoký příjem vitamínu K může překonat antikoagulační účinek antagonistů vitamínu K. Pacienti užívající tyto léky musí hlídat příjem vitamínu K potravou. Odborníci radí konzumovat stabilní množství vitamínu K bez větších výkyvů. Stabilita v příjmu neznamená restrikci v příjmu. I lidé užívající warfarin mohou přijímat 90–120 mikrogramů/den, což jsou současná dietní doporučení pro zdravou dospělou populaci.[8]
Mineralizace kostí
V kostech byly izolovány tři vitamín K dependentní proteiny: osteokalcin, matrix GLA protein (MGP) a protein S. Osteokalcin (nazývaný také kostní GLA protein) je protein syntetizovaný osteoblasty (buňkami tvořícími kost). Syntéza osteokalcinu osteoblasty je regulována aktivní formu vitamínu D, tzv. 1,25 (OH)2 D3, neboli kalcitriolem. Schopnost osteokalcinu vázat minerály je podmíněna vitamín K dependentní gama-karboxylací tří zbytků (reziduí) kyseliny glutamové. Funkce osteokalcinu souvisí s kostní mineralizací. MGP byl nalezen v kostech, chrupavkách a měkkých tkáních včetně cév. Výsledky studií na zvířatech naznačují, že MGP zabraňuje kalcifikaci měkkých tkání a chrupavek, a zároveň usnadňuje normální růst a zrání kostí. Vitamín K dependentní antikoagulační protein S je syntetizován osteoblasty, ale jeho role v kostním metabolismu je nejasná. Děti se zděděnou deficiencí proteinu S trpí komplikacemi souvisejícími se zvýšenou krevní srážlivostí, stejně jako se sníženou hustotou kostního minerálu.[6][9][10]
Buněčný růst
Gas6 je vitamín K dependentní protein objevený v roce 1993. Byl nalezen v nervovém systému, v srdci, plicích, žaludku, ledvinách a chrupavkách. Ačkoliv přesný mechanismus jeho účinku nebyl stanoven, Gas6 se jeví jako regulační faktor buněčného růstu s buněčně-signálními aktivitami. Gas6 se zdá být důležitý u různých buněčných funkcí, jako při buněčné adhezi, proliferaci buněk a ochraně proti apoptóze.6 Může hrát důležitou roli ve vývoji a stárnutí nervového systému,[11][12] při regulaci krevních destiček a při cévní homeostáze.[13]
Nedostatek vitamínu K
Nedostatek vitamínu K vede k poruchám krevní srážlivosti, jak prokazují laboratorní testy měřící koagulační čas. Mezi příznaky patří modřiny, krvácení z nosu a dásní, krev v moči a ve stolici, nebo extrémně těžké menstruační krvácení. U kojenců může vést nedostatek vitamínu K k život ohrožujícímu krvácení (k intrakraniální hemoragii).[7] Nedostatek vitamínu K dále souvisí s řídnutím kostí (osteoporózou) u žen po menopauze. Nedostatek vitamínu K způsobuje špatnou karboxylaci osteokalcinu a sníženou aktivitu osteoblastů (kostních buněk obnovujících kost). Dochází k pomalejší obnově kostí a k nedostatečnému zabudování vápníku do kostí. Kosti pak nejsou dostatečně pevné a odolné, snadno se lámou. Nedostatek vitamínu K zvyšuje riziko osteoporotické zlomeniny.[14]
Nedostatek vitamínu K u dospělých
Nedostatek vitamínu K pro normální srážení krve není u běžně se stravujících zdravých dospělých obvyklý z několika důvodů: 1. vitamín K je přítomen v listové zelenině 2. cyklus vitamínu K jej obnovuje 3. bakterie, které normálně obývají tlusté střevo, syntetizují menachinon – vitamín K2. K dospělým ohroženým nedostatkem vitamínu K patří ti, kteří užívají antagonisty vitamínu K (antikoagulační léky), nebo jednotlivci s významným poškozením nebo onemocněním jater.[7] Dále mohou být vystaveni zvýšenému riziku deficience vitamínu K jedinci s poruchami absorpce tuku.[5]
Zvláštní pozornost se nyní věnuje stanovení požadavku na příjem vitamínu K z hlediska ostatní funkce v organizmu, nejen pro srážení krve. Ukazuje se, že požadavky pro zajištění zdravého metabolismu kostí a cévní stěny budou patrně mnohem vyšší, než je tomu u koagulace a že současná doporučení nemusejí být dostatečná. Expertní skupiny dokonce vyjadřují názor, že až 90% dospělé západní populace může mít nedostatek vitamínu K pro potřeby normálního metabolismu kostí.[15]
Nedostatek vitamínu K u kojenců
Novorozenci, kteří jsou výhradně kojeni, jsou vystaveni zvýšenému riziku nedostatku vitamínu K, protože mateřské mléko má relativně nízký obsah vitamínu K. Novorozenci mají obecně nízkou hladinu vitamínu K, protože: 1. vitamín K se špatně přenáší přes placentární bariéru 2. střeva novorozenců nejsou dosud kolonizována bakteriemi syntetizujícími menachinon 3. cyklus vitamínu K nemusí být u novorozenců plně funkční, zejména u těch předčasně narozených.[5] Kojenci, jejichž matky jsou na antikolvuzivní terapii, jsou také ohroženi nedostatkem vitamínu K. Jeho nedostatek u novorozenců může vést až ke krvácení. Protože takové krvácení je život ohrožující a snadno se mu dá předejít, dostávají novorozenci vitamín K1.[16]
Doporučený příjem vitamínu K1
V lednu 2001 americký Výbor pro potraviny a výživu stanovil adekvátní příjem vitamínu K v USA, založený na úrovni spotřeby zdravých jedinců. AI pro kojence byl stanoven na základě odhadovaného příjmu vitamínu K z mateřského mléka.[17]
| Fáze života | Věk | Chlapci/Muži (µg/den) | Dívky/Ženy (µg/den) |
|---|---|---|---|
| Kojenci | 0–6 měsíců | 2 | 2 |
| Kojenci | 7–12 měsíců | 2,5 | 2,5 |
| Děti | 1–3 roky | 30 | 30 |
| Děti | 4–8 roky | 55 | 55 |
| Děti | 9–13 roky | 60 | 60 |
| Mladiství | 14–18 let | 75 | 75 |
| Dospělí | 19 let a starší | 120 | 90 |
| V těhotenství | 18 let a mladší | – | 75 |
| V těhotenství | 19 let a starší | – | 90 |
| Při kojení | 18 let a mladší | – | 75 |
| Při kojení | 19 let a starší | – | 90 |
Prevence onemocnění
Osteoporóza
Objev tzv. vitamín K dependentních bílkovin v kostech vedl k výzkumu úlohy vitamínu K při zachovávání zdravých kostí.
Podávání vitamínu K a osteoporotické zlomeniny
Epidemiologické studie prokázaly souvislost mezi vitamínem K a řídnutím kostí v souvislosti s věkem (tzv. osteoporózou). The Nurses' Health Study se účastnilo více než 72 000 žen po dobu deseti let. Ženy, jejichž příjem vitamínu K byl v nejnižším kvintilu (pětině), měly o 30% vyšší riziko zlomeniny krčku kosti stehenní než ženy s příjmem vitamínu K ve čtyřech vyšších kvintilech.[18] Studie s více než 800 starších mužů a žen v sedmileté Framinghamské studii zjistila, že muži a ženy s příjmem vitamínu K v nejvyšším kvartilu (čtvrtině), měli o 65% nižší riziko zlomeniny krčku kosti stehenní, než Ti s příjmem vitamínu K v nejnižším kvartilu (přibližně 250 ug/den oproti 50 ug/den). Další studie prokázaly zvýšení hustoty kostního minerálu (BMD) díky podávání vitamínu K spolu s vitamínem D3, nebo snížený výskyt zlomenin obratlů v kombinaci s léčbou bisfosfonáty.[19][20]
Vitamín K dependentní karboxylace osteokalcinu a osteoporotické fraktury
Osteokalcin, bílkovina cirkulující v krvi, se ukázala být citlivým ukazatelem stavu kostní novotvorby. Vitamín K je nutný pro gama-karboxylaci osteokalcinu. Podkarboxylovaný osteokalcin (ucOC) má nižší schopnost vázat kostní minerál. Stupeň gama-karboxylace osteokalcinu se ukazuje jako citlivý ukazatel hladiny vitamínu K v organizmu.[4] Bylo zjištěno, že hladiny ucOC jsou vyšší u žen po menopauze než před ní a výrazně vyšší u žen starších 70 let. Ve studii se 195 staršími ženami bylo relativní riziko fraktury krčku kosti stehenní 6x vyšší u těch, které měly zvýšené hladiny ucOC na počátku studie.[21] U většího vzorku 7 500 samostatně žijících starších žen hladina ucOC také predikovala riziko zlomeniny.[22]
Antagonisté vitamínu K a osteoporotické zlomeniny
O některých orálních antikoagulanciích, např. warfarinu, je známo, že jsou tzv. antagonisté vitamínu K. Studie zkoumající chronické užívání warfarinu a riziko fraktur u starších žen zjistila výrazně vyšší riziko zlomenin obratlů a žeber u uživatelek warfarinu ve srovnání s pacientkami bez warfarinu.[23]
Zdroje
Potravinové zdroje vitamínu K1
Fylochinon (vitamín K1) je obsažen v zelené listové zelenině a některých rostlinných olejích (sojový, olivový, v bavlníkovém semenu, řepce). Hydrogenace rostlinných olejů může snížit biologickou účinnost vitamínu K.[2] Některé zdroje vitamínu K1 jsou uvedeny v následující tabulce spolu s obsahem vitamínu K1 v mikrogramech (μg).
| Potravina | Množství | Vitamín K1 (μg) |
|---|---|---|
| Olivový olej | 1 polévková lžíce[ujasnit] | 8,1 |
| Sojový olej | 1 polévková lžíce | 25,1 |
| Řepkový olej | 1 polévková lžíce | 16,6 |
| Majonéza | 1 polévková lžíce | 3,7 |
| Vařená brokolice | 1 hrnek[ujasnit] (sekané) | 220 |
| Syrová kapusta | 1 hrnek (sekané) | 547 |
| Syrový špenát | 1 hrnek (sekané) | 145 |
| Syrový zelený listový salát | 1 hrnek (drcený) | 62,5 |
| Syrová řeřicha | 1 hrnek (sekané) | 85 |
| Syrová petržel | 1/4 hrnku (sekaná nať) | 246 |
Zdroje vitamínu K2
Bakterie, které normálně kolonizují tlusté střevo, syntetizují menachinon (vitamín K2). Až donedávna bylo uváděno, že až 50% potřebného vitamínu K může být pokryto bakteriální syntézou. Nyní výzkum ukazuje, že podíl bakteriální syntézy je mnohem menší, než se uvažovalo.[24]
Doplňky stravy
V České republice je v některých doplňcích stravy možno získat vitamíny K1 a K2 i bez lékařského předpisu. Rozdíl mezi vitamíny K1 a K2 je ve vstřebávání a ve využití v organizmu. Vitamínu K1 se dostane do oběhu 5 – 15% podaného množství, u vitamínu K2 je to 95 – 100%. Vitamín K1 je v organizmu použit pro potřeby srážení krve a rychle se z těla vyloučí, K2 vytváří v organizmu dlouhodobou hladinu, ze které je využíván zejména pro metabolismus kostí a cév. Vzhledem k uvedenému se jeví jako výhodnější podávat vitamín K2.
Bezpečnost
Toxicita
Přestože alergická reakce je možná, neexistuje žádná známá toxicita spojená s vysokými dávkami při podávání vitamínu K1 nebo K2.[17] To neplatí pro syntetický menadion (vitamín K3) a jeho deriváty. Menadion může narušovat funkci glutathionu, jednoho z přirozených antioxidantů v lidském organizmu, což má za následek oxidační poškození buněčných membrán. Menadion podávaný injekčně indukoval jaterní toxicitu, žloutenku a hemolytickou anémii u dětí. Proto menadion již není používán k léčbě deficience vitamínu K.[5][7]
Interakce s jinými živinami
Velké dávky vitamínu A a vitamínu E fungují jako antagonisté vitamínu K.[7] Přebytek vitamínu A pravděpodobně ovlivňuje vstřebávání vitamínu K. Vitamín E může inhibovat vitamín K dependentní karboxylázy. Studie u dospělých s normálním koagulačním stavem shledala, že při podání 1000 IU vitamínu E po dobu 12 týdnů klesla gama-karboxylace protrombinu, vitamín K dependentního proteinu. Hlášeno bylo také nadměrné krvácení u lidí užívajících 5 mg warfarinu a 1200 IU vitamínu E denně.[25]
Lékové interakce
Antikoagulační účinek antagonistů vitamínu K (např. warfarinu), může být inhibován vysokým příjmem vitamínu K. Jiné léky mohou interferovat s endogenní syntézou vitamínu K nebo ovlivňovat regeneraci vitamínu K. Delší používání širokospektrých antibiotik může snižovat syntézu vitamínu K střevními bakteriemi. Cefalosporiny a salicyláty mohou snižovat regeneraci vitamínu K inhibicí enzymu vitamín K epoxid reduktázy. Dále cholestyramin, cholestipol, orlistat, minerální oleje a tuky mohou snížit vstřebávání vitamínu K.[14]
Odkazy
Reference
- Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
- Shearer MJ. Vitamin K. Lancet. 1995;345(8944):229-234.
- Okano T, Shimomura Y, Yamane M, et al. Conversion of Phylloquinone (Vitamin K1) into Menaquinone-4 (Vitamin K2) in Mice: TWO POSSIBLE ROUTES FOR MENAQUINONE-4 ACCUMULATION IN CEREBRA OF MICE. J Biol Chem. 2008;283(17):1270-1279.
- Booth SL, Suttie JW. Dietary intake and adequacy of vitamin K. J Nutr. 1998;20(5):785-788.
- Ferland G. Vitamin K. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 9th ed. Volume 1. Washington, D.C.: ILSI Press; 2006:220-230.
- Shearer MJ. The roles of vitamins D and K in bone health and osteoporosis prevention. Proc Nutr Soc. 1997;56(3):915-937.
- Olson RE. Vitamin K. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:363-380.
- Booth SL, Centurelli MA. Vitamin K: a practical guide to the dietary management of patients on warfarin. Nutr Rev. 1999;57(9 Pt 1):288-296.
- Booth SL. Skeletal functions of vitamin K-dependent proteins: not just for clotting anymore. Nutr Rev. 1997;55(7):282-284.
- Suttie JW. Vitamin K. In: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease. 10th ed. Baltimore: Lippincott Williams & Wilkins; 2006:412-425.
- Ferland G. The vitamin K-dependent proteins: an update. Nutr Rev. 1998;56(8):223-230.
- Tsaioun KI. Vitamin K-dependent proteins in the developing and aging nervous system. Nutr Rev. 1999;57(8):231-240.
- Maree AO, Jneid H, Palacios IF, Rosenfield K, MacRae CA, Fitzgerald DJ. Growth arrest specific gene (GAS) 6 modulates platelet thrombus formation and vascular wall homeostasis and represents an attractive drug target. Curr Pharm Des. 2007;13(26):2656-2661.
- Booth SL, Golly I, Sacheck JM, et al. Effect of vitamin E supplementation on vitamin K status in adults with normal coagulation status. Am J Clin Nutr. 2004;80(1):143-23.
- Štěpán J. Význam vitaminu K pro kvalitu kosti a pro kalcifikované tkáně. Prakt. Lék. 2005;6:326-330.
- Thorp JA, Gaston L, Caspers DR, Pal ML. Current concepts and controversies in the use of vitamin K. Drugs. 1995;49(3):376-387.
- Food and Nutrition Board, Institute of Medicine. Vitamin K. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, D.C.: National Academy Press; 2001:162-196.
- Feskanich D, Weber P, Willett WC, Rockett H, Booth SL, Colditz GA. Vitamin K intake and hip fractures in women: a prospective study. Am J Clin Nutr. 1999;69(1):74-79.
- Iwamoto J, Takeda T, Ichimura S. Effect of combined administration of vitamin D3 and vitamin K2 on bone mineral density of thr lumbar spine in postmenopausal women with osteoporosis. J Orthop Sci. 2000; 5:546-551.
- Iwamoto J, Takeda T, Ichimura S. Combined treatment with vitamin K2 and bisphosphonate in postmenopausal women with osteoporosis. Yonsei Medical Journa. 2003;44(5):751-756.
- Szulc P, Chapuy MC, Meunier PJ, Delmas PD. Serum undercarboxylated osteocalcin is a marker of the risk of hip fracture in elderly women. J Clin Invest. 1993;91(4):1769-1774.
- Vergnaud P, Garnero P, Meunier PJ, Breart G, Kamihagi K, Delmas PD. Undercarboxylated osteocalcin measured with a specific immunoassay predicts hip fracture in elderly women: the EPIDOS Study. J Clin Endocrinol Metab. 1997;82(3):719-724.
- Caraballo PJ, Heit JA, Atkinson EJ, et al. Long-term use of oral anticoagulants and the risk of fracture. Arch Intern Med. 1999;159(15):1750-1756.
- Broulík P. Výživa a její vztah ke kostnímu metabolismu. Interní Med. 2009;11(3):11-14.
- Corrigan JJ, Jr., Marcus FI. Coagulopathy associated with vitamin E ingestion. JAMA. 1974;230(9):1300-1301.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu vitamín K na Wikimedia Commons
Obrázky, zvuky či videa k tématu vitamín K na Wikimedia Commons