Aktivní místo
Aktivní místo (též aktivní centrum) je oblast enzymu, kde dochází k enzymatické reakci.[1] Je to místo ve struktuře enzymu, kam se váží substráty a kde jsou přeměňovány na produkty. Aktivní místo bývá umístěno na povrchu enzymové molekuly, neboť musí být volně přístupné pro přistupující substráty. Obvykle mívá tvar mělké prohlubně, štěrbiny nebo jamky.
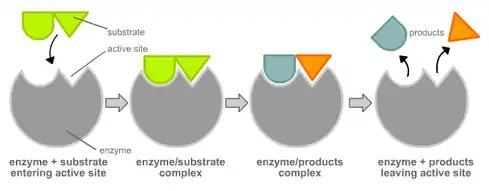
Vyskytují se zde katalyticky aktivní aminokyselinové zbytky.[2] Tyto funkční skupiny jsou přesně prostorově rozmístěné a nacházejí se ve vzájemné blízkosti, ač původně mohly ležet na odlišných koncích polypeptidového řetězce enzymu.
Některé funkční skupiny se podílejí na vlastní katalýze (katalytické centrum), jiné umožňují vazbu substrátu (vazebné centrum) a další vytvářejí vhodné chemické prostředí pro průběh reakce.
Součástí aktivního centra mohou být pevně vázané prosthetické skupiny enzymu (například ionty kovů u metaloenzymů) nebo volně vázané koenzymy, které mohou volně přecházet mezi apoenzymy.
Historie

Postupně byly vytvořeny dvě teorie interakce mezi molekulou substrátu a aktivním místem enzymu. Při vazbě substrátu na enzym dochází k vytvoření komplexu enzym-substrát buď podle teorie zámku a klíče nebo indukovaného přizpůsobení:
- Teorie zámku a klíče (lock and key) byla vytvořena německým chemikem Hermanem Emilem Fischerem koncem 19. století. Tato teorie předpokládala, že molekula substrátu přesně zapadá do molekuly enzymu.
- Teorie indukovaného přizpůsobení (induced fit theory) byla vytvořena americkým biochemikem Danielem Edwardem Koshlandem ve 20. století. Tento model popisuje interakci mezi enzymem a substrátem lépe než původní model. Říká, že substrát (nebo i enzym) dokáže do jisté míry přizpůsobit sebe nebo aktivní místo, na něž se váže. Přesného tvaru zámku a klíče se tedy dosáhne až po navázání substrátu.
 Teorie indukovaného přizpůsobení
Teorie indukovaného přizpůsobení
Tvary aktivních míst
Tvar enzymu může být různý a tím jsou různá i aktivní centra, kde dochází ke katalýze a kde by měl být substrát dostatečně uchráněn před okolním vodným prostředím. Poblíž aktivního centra se obvykle nachází oblast, která váže koenzym nebo prostetickou skupinu. Aktivní místa mají nejčastěji tento tvar:
- pukliny (například štěrbiny některých hydroláz, biopolymerní řetězce do nich zapadnou jako drát do štípacích kleští)
- mělké povrchové prohlubně (například u různých trávicích enzymů)
- jamky (například u enzymů - karboxypeptidáza, jež z dlouhých molekul odštěpují jejich krátký konec).
Interakce substrátu a enzymu
Aktivní místo, kde substrát reaguje s molekulou enzymu, je tvořeno vazebným a katalytickým místem. Přesné rozlišení vazebného a katalytického místa je ale obvykle problematické.
Vazebné místo enzymu
Vazebné místo enzymu je prostorově vymezená, malá část molekuly enzymu obsahující přesně rozmístěné funkční skupiny (například −SH, −OH, kyselé a bazické aminokyseliny), jejichž postavení odpovídá struktuře substrátu. Na vazbě mezi enzymem a substrátem se podílejí nevazebné interakce (vodíkové můstky, elektrostatické a hydrofobní interakce, van der Waalsovy síly). Kovalentní vazby vznikají jen výjimečně.
Katalytické místo enzymu
Katalytické místo obsahuje další skupiny zodpovědné za katalytickou aktivitu enzymu. Tyto skupiny často pocházejí z molekuly kofaktoru, tedy prostetické skupiny nebo koenzymu.
Další místa enzymu
Kromě aktivního místa se na povrchu enzymu mohou nacházet i místa alosterické regulace (z latinského allos – jiný, stereos – prostor), umožňující regulaci aktivity enzymu vlivem různých inhibitorů nebo aktivátorů. Alosterická regulace mění prostorovou strukturu ovlivňovaných enzymů a vytváří tak vhodné chemické prostředí pro průběh enzymatické reakce.
Reference
V tomto článku byly použity překlady textů z článků Active center (polymer science) na anglické Wikipedii a Aktives Zentrum na německé Wikipedii.
Externí odkazy
 Obrázky, zvuky či videa k tématu aktivní místo na Wikimedia Commons
Obrázky, zvuky či videa k tématu aktivní místo na Wikimedia Commons