Abramovova reakce
Abramovova reakce je organická reakce, při níž dochází k přeměně trialkylového fosfonátu na α-hydroxyfosfonát adicí na karbonylovou sloučeninu. Mechanismus obsahuje atak nukleofilního atomu fosforu na karbonylový uhlík.[1]
Reakci objevil ruský chemik Vasilij Semjonovič Abramov v roce 1957.[2]
Úvod
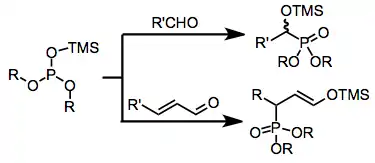
Zdroje fosforu bohaté na elektrony, jako jsou fosfity, fosfonity a fosfinity, mohou být nukleofilně adovány na karbonylové sloučeniny. Při použití plně esterifikovaných fosfitů (tedy Abramovově reakci) obvykle dochází k neutralizaci vytvořeného tetraedrického meziproduktu přenosem alkylové nebo silylové skupiny z kyslíkového atomu navázaného na fosfor za tvorby alkoxidového centra. Poté se může objevit konjugovaná adice,[3] jejímiž produkty jsou γ-funkcionalizované karbonylové sloučeniny nebo enolethery. Rozsah reakce lze výrazně zvětšit použitím zdrojů fosforu obsahujících siloxyskupiny, protože vzniklé α-siloxysloučeniny mohou být v alkoholových rozpouštědlech přeměněny na odpovídající α-hydroxyderiváty.[4]
(1)
Mechanismus a stereochemie
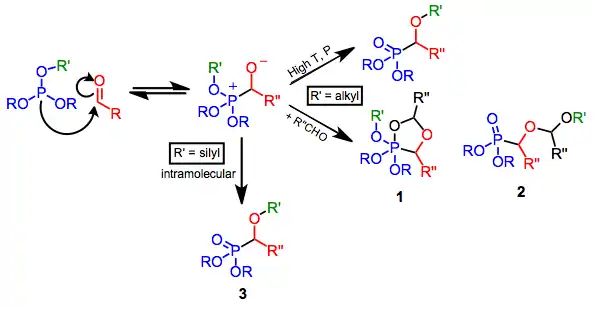
Převažující mechanismus
Fosfit se vratně naváže na karbonylový uhlík. Za mírných podmínek probíhá zpětná přeměna na výchozí látky rychleji než mezimolekulární i vnitromolekulární přesuny alkylových skupin, protože přechodný stav vznikající při vnitromolekulárním přesunu má malý překryv orbitalů.[5]
Přesun lze účinně provést při zvýšení teploty a/nebo tlaku. Jsou-li použity dva ekvivalenty aldehydu, tak adice tetraedrického meziproduktu na druhou molekulu aldehydu může probíhat za tvorby fosforanu 1 nebo lineárního alkylového produktu 2.
Vhodnější je použití silylovaných zdrojů fosforu, které vstupují do vnitromolekulárních přesunů silylových skupin z přední strany, čímž vznikají α-siloxyfosforové sloučeniny 3.[6]
(3)
Rozsah a omezení
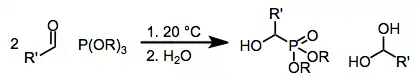
Fosforové reaktanty
Na přípravu α-hydroxyfosfonátů se obvykle používají fosfity. Za přítomnosti dvou ekvivalentů aldehydů převažují cyklické fosforany 1, které ovšem mohou snadno být hydrolyzovány na odpovídající hydroxyfosfonáty.[7]
(6)
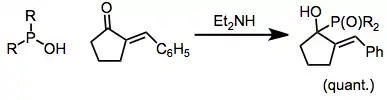
Když jsou použity fosfonové kyseliny s katalytickým množstvím zásady, tak mohou vznikat fosfinoxidy. Vhodné jsou pro tyto reakce sodné soli fosfonových kyselin a jako zásadu je možné použít například amid sodný.[8]
Asymetrické a selektivně řízené adice lze dosáhnout využitím chirálních aminů.[9]
(7)
Objev a použití silylovaných fosforových reaktantů představuje významný pokrok v této reakci. U smíšených reaktantů dochází k selektivním přenosům silylových skupin a štěpení za vzniku vazeb křemík-kyslík je často možné provést hydrolyticky, což umožňuje získávat α-hydroxyderiváty. Alkylace α-siloxy produktů představuje vhodný způsob jinak obtížné přípravy α-alkoxyfosforových sloučenin, které mohou po deprotonaci fungovat jako ekvivalenty acylových aniontů, z nichž se po eliminaci v zásaditém prostředí mohou stát ketony.[10]
(8)
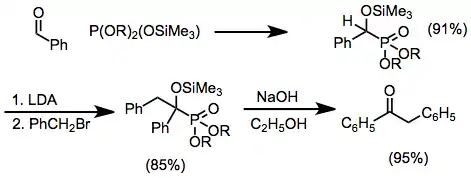
Karbonylové substráty
Na karbonylové uhlíky jednoduchých aldehydů a ketonů se fosfity adují snadno; při adicích na keteny se tvoří stejné produkty jako u Arbuzovových reakcí acylhalogenidů.[11]
(9)
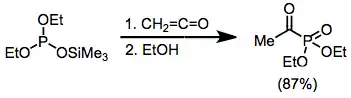
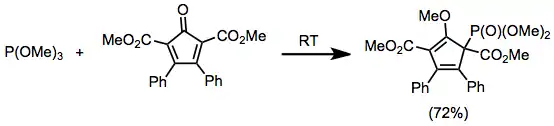
Do této reakce mohou rovněž vstupovat α,β-nenasycené ketony a aldehydy. U dienylkarbonylových substrátů probíhají 1,6-adice.[12]
(10)
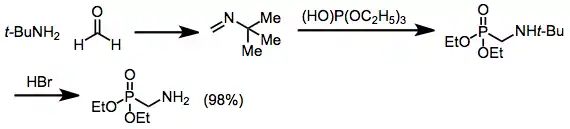
Varianta, do které jsou zapojeny iminy se nazývá Pudovikova reakce, vznikají při ní α-alkylaminofosfonáty.[13]
Primární aminy je možné získat pouze po kyselé hydrolýze terc-butylaminového meziproduktu;[14] použití nesubstituovaných iminů vyžaduje tvrdé reakční podmínky a výtěžnost bývá nízká.
(11)
Syntetické využití
α-Hydroxyalkylfosfonáty připravené Abramovovou reakcí lze použít na další přeměny. Původně karbonylový uhlík je v důsledku své blízkosti k fosfonátové skupině kyselý. Jeho deprotonací vzniká maskovaný acylový anion, ze kterého lze odštěpit fosfonátovou skupinu. Fosfonátové anionty se mohou účastnit alkylací a alkenací (jako je Hornerova–Wadsworthova–Emmonsova reakce).[15]
Pokud jsou do alkenace zapojeny α-aminoalkylfosfonáty, tak se vzniklé enaminy dají hydrolyzovat za vzniku ketonů.
(12)
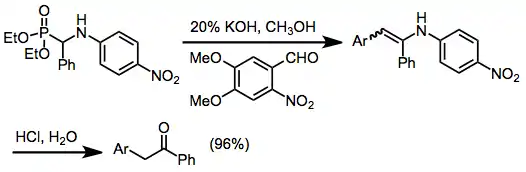
Adicemi na nenasycené karbonylové sloučeniny a následnými deprotonacemi vznikají ekvivalenty homoenolátů.
Srovnání s ostatními metodami
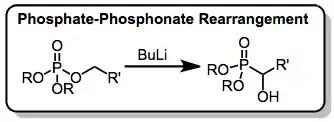
Silylovaná fosfitová činidla patří k nejúčinnějším při přípravě α-hydroxyfosfonátů, existuje však i několik dalších způsobů tvorby těchto sloučenin. Příkladem může být fosfáto-fosfonátový přesmyk, kdy se α-hydroxyfosfonáty vytváří z tříčlenného cyklického meziproduktu.[16]
(13)
Experimentální podmínky a postupy
Provedení adicí sloučenin fosforu je obecně jednoduché. Reaktanty mohou být rozpuštěny v polárních rozpouštědlech, jako jsou acetonitril, ethanol a terc-butanol, a nepolárích rozpouštědlech, například benzenu. Při adicích fosfitových diesterů nebo in situ tvorbě iminů může být nutná kyselá katalýza; v ostatních případech lze k tomuto účelu použít též zásady. K izolaci čistých produktů obvykle postačuje destilace.
Odkazy
Související články
- Michaelisova–Arbuzovova reakce - reakce trialkylfosfitu s alkylhalogenidem za vzniku fosfonátu
Reference
V tomto článku byl použit překlad textu z článku Abramov reaction na anglické Wikipedii.
- R. Engel. Phosphorus Addition at sp² Carbon. Organic Reactions. 2004, s. 175–248. ISBN 0471264180. DOI 10.1002/0471264180.or036.02.
- Аркадий Николаевич Пудовик iopc.ru
- M. Sekine; I. Yamamoto; A. Hashizume; T. Hata. Silyl Phosphites V. The Reactions of Tris(Trimethylsilyl) Phosphite with Carbonyl Compounds. Chemical Letters. 1977, s. 485–488. DOI 10.1246/cl.1977.485.
- D. Ranganathan; B. Rao; S. Ranganathan. Nitroethylene: Synthesis of novel 2-nitroethylphosphonates. Journal of the Chemical Society, Chemical Communications. 1979, s. 975. DOI 10.1039/c39790000975.
- A. Ginsberg; Y. Jakubovich. Zh. Obshch. Khim.. 1960, s. 3979.
- Sommer, H. Stereochemistry, Mechanism and Silicon, McGraw-Hill, New York, 1965, pp. 176–178.
- F. Ramirez; B. Bhatia; P. Smith. Reaction of trialkyl phosphites with aromatic aldehydes. Tetrahedron. 1967, s. 2067. DOI 10.1016/0040-4020(67)80040-1.
- A. Pudovik; Arbuzov. Dokl. Akad. Nauk SSSR. 1950, s. 327.
- H. Wynberg; A. Smaardijk. Asymmetric catalysis in carbon-phosphorus bond formation. Tetrahedron Letters. 1983, s. 5899. DOI 10.1016/S0040-4039(00)94232-1.
- H. Horner; H. Roder. Phosphororganische Verbindungen, 67. Notiz über die reduktive Umwandlung von Carbonsäuren in ihre Aldehyde. Chemische Berichte. 1970, s. 2984. DOI 10.1002/cber.19701030936.
- M. Mirsalikhova; A. Baranova; L. Tunitskaya; N. Gulyaev. Biokhimiya. 1981, s. 258.
- A. Arbuzov; V. Fuzhenkova; F. Rozhkova.Chybí název periodika! 1982, s. 10.
- R. Tyka. Novel synthesis of α-aminophosphonic acids. Tetrahedron Letters. 1970, s. 317–680. DOI 10.1016/S0040-4039(01)97800-1.
- K. Moedritzer. A Novel Synthesis of Aminomethylphosphonic Acid. Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry. 1970, s. 317–327. DOI 10.1080/00945717208069617.
- W. Wadsworth. Synthetic Applications of Phosphoryl-Stabilized Anions. Organic Reactions. 1977, s. 73–253. ISBN 0471264180. DOI 10.1002/0471264180.or025.02.
- G. Sturtz; B. Corbel; J.-P. Paugam. Nouveaux synthons phosphores : Bianions d'hydroxy-1 propene-2 YL phosphonamides, carbanions en β d'acides carboxyliques potentiels. Tetrahedron Letters. 1976, s. 47–50. DOI 10.1016/S0040-4039(00)71319-0.