2-nitroanilin
2-Nitroanilin je organická sloučenina se vzorcem C6H4NH2NO2. Jedná se o derivát anilinu, který má nitroskupinu na pozici 2. Používá se na výrobu o-fenylendiaminu.
| 2-nitroanilin | |
|---|---|
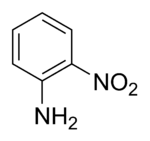
Strukturní vzorec | |
Tyčinkový model molekuly | |
| Obecné | |
| Systematický název | 2-nitroanilin |
| Ostatní názvy | 2-nitrobenzen-1-amin, 2-nitrofenylamin, o-nitroanilin |
| Funkční vzorec | C6H4NH2NO2 |
| Sumární vzorec | C6H6N2O2 |
| Vzhled | oranžová pevná látka |
| Identifikace | |
| Registrační číslo CAS | 88-74-4 |
| EC-no (EINECS/ELINCS/NLP) | 201-855-4 |
| PubChem | 6946 |
| SMILES | O=[N+]([O-])c1ccccc1N |
| InChI | 1/C6H6N2O2/c7-5-3-1-2-4-6(5)8(9)10/h1-4H,7H2 |
| Číslo RTECS | BY6650000 |
| Vlastnosti | |
| Molární hmotnost | 138,124 g/mol |
| Teplota tání | 71 °C (344 K)[1] |
| Teplota varu | 284 °C (557 K)[1] |
| Hustota | 1,44 g/cm3[1] |
| Rozpustnost ve vodě | 0,147 g/100 ml (30 °C)[1] |
| Tlak páry | 4 Pa (20 °C)[1] |
| Měrná magnetická susceptibilita | −4,81×105 μm3/g |
| Termodynamické vlastnosti | |
| Standardní molární spalná entalpie ΔH°sp | −3204 kJ/mol[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H301 H311 H331 H373 H412[1] |
| P-věty | P260 P261 P264 P270 P271 P273 P280 P301+310 P302+352 P304+340 P311 P312 P314 P321 P322 P330 P361 P363 P403+233 P405 P501[1] |
| Teplota vzplanutí | 168 °C (441 K)[1] |
| Teplota vznícení | 521 °C (794 K)[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba a příprava
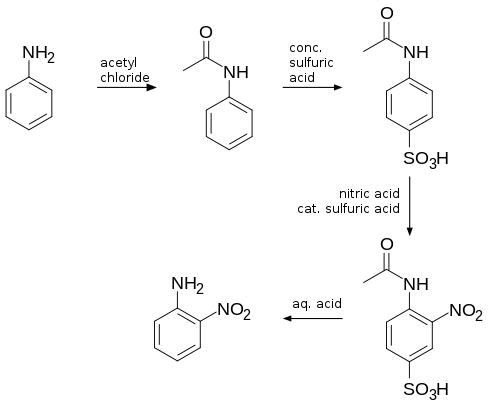
2-Nitroanilin se vyrábí reakcí 2-nitrochlorbenzenu s amoniakem:[2]
- ClC6H4NO2 + 2 NH3 → H2NC6H4NO2 + NH4Cl
Existuje mnoho dalších způsobů přípravy této látky, přičemž přímá nitrace je kvůli tvorbě aniliniových kationtů neúčinná. Nitrací acetanilidu vzniká jen velmi malé množství 2-izomeru, protože amidová skupina vytváří výrazný sterický efekt. K zabránění substituce do polohy 4 se používá sulfonace, která zvyšuje výtěžnost reakce na 56 %.[3]
Reakce a použití
2-Nitroanilin se používá na výrobu o-fenylendiaminu, který dále slouží k přípravě benzimidazolů, skupiny heterocyklických sloučenin používaných při výrobě řady léčiv.[2]
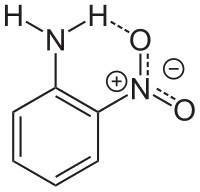
Kromě redukce na fenylendiamin může u 2-nitroanilinu proběhnout několik dalších reakcí obvyklých u aromatických aminů. Protonací z něj lze získat aminiové soli. Kvůli vlivu nitroskupiny je asi 100 000krát slabší zásadou něž samotný anilin. Diazotací se z něj získávají diazoniové soli, používané jako prekurzory azobarviv.[4] Acetylací 2-nitroanilinu vzniká 2-nitroacetanilid.
Odkazy
Související články
- 3-nitroanilin
- 4-nitroanilin
Externí odkazy
 Obrázky, zvuky či videa k tématu 2-nitroanilin na Wikimedia Commons
Obrázky, zvuky či videa k tématu 2-nitroanilin na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku 2-Nitroaniline na anglické Wikipedii.
- 2-Nitroaniline. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Gerald Booth. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2007. Kapitola Nitro Compounds, Aromatic, s. 606–607.
- Solomons T. W. Grahan; B. Fryhle Craig; A. Snyder Scott. Organic chemistry. [s.l.]: [s.n.], 2011. (11). ISBN 978-1119077251. S. 606–607.
- G. Wittig; R. W. Hoffmann. 1,2,3-Benzothiadiazole 1,1-Dioxide. [s.l.]: [s.n.], 1967. S. 4.

